금 산화물 (III) (Au2O3) 구조, 성질, 명칭 및 용도
그 산화 금 (III) 화학식이 Au 인 무기 화합물2O3. 이론적으로 사람은 그 본성이 공유 형일 것으로 기대할 수 있습니다. 그러나, 고체에 특정 이온 성질의 존재는 모두 폐기 될 수 없다. 또는 무엇이 같은가, Au 양이온이 없다고 가정한다3+ 음이온 옆에 O2-.
귀금속 인 금이 부식 될 수 있다는 것은 상반된 것처럼 보일 수 있습니다. 정상 상태에서, 금 조각 (아래 이미지의 별과 같은)은 대기 중의 산소와의 접촉에 의해 산화 될 수 없습니다. 그러나, 오존의 존재하에 자외선을 조사 할 때, OR3, 사진이 다르다..

금색 별이 이러한 조건을 겪게되면 Au의 특징 인 적갈색을 띠게됩니다.2O3.
이 산화물을 얻는 다른 방법은 상기 항성의 화학적 처리를 포함 할 것이다; 예를 들어, 금괴를 각각의 염화물, AuCl3.
이후, AuCl로3, 형성 될 수있는 가능한 금 염의 나머지에는 강 염기성 매질이 첨가된다; 그리고 이것으로 수화 된 산화물 또는 수산화물, Au (OH)3. 마지막으로,이 마지막 화합물을 열 탈수시켜 Au2O3.
색인
- 1 산화 금 (III)의 구조
- 1.1 전자적 측면
- 1.2 수화물
- 2 속성
- 2.1 외관
- 2.2 분자 질량
- 2.3 밀도
- 2.4 융점
- 2.5 안정성
- 2.6 용해도
- 3 명칭
- 4 용도
- 4.1 안경 색칠
- 4.2 aurates와 fulminating 금의 합성
- 4.3 자기 조립 단분자층의 취급
- 5 참고
산화 금 (III)의 구조
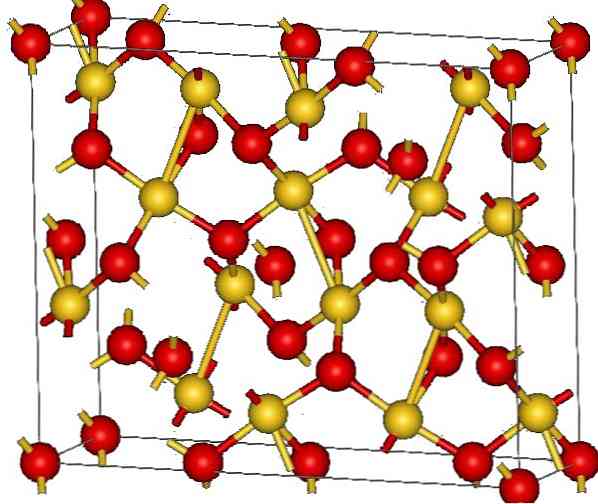
산화 금 (III)의 결정 구조가 상부 그림에 나타나있다. 고체에서 금과 산소 원자의 배열은 중성 원자 (공유 결합 고체) 또는 이온 (이온 성 고체)으로 표시됩니다. 명백하게, Au-O 링크를 제거하거나 배치하는 것으로 충분합니다.
이미지에 따르면, 공유 적 문자가 지배적 인 것으로 가정합니다 (논리적 일 것입니다). 그 이유로, 대표되는 원자 및 결합은 각각 구 및 막대로 표시됩니다. 황금 구체는 금 원자 (AuIII-O), 산소 원자가 적색.
주의 깊게 보면, AuO 단위가 있음을 알 수 있습니다.4, 이들은 산소 원자에 의해 결합되어있다. 그것을 시각화하는 또 다른 방법은 각 Au3+ 4 개의 O에 둘러싸여있다.2-; 물론, 이온 관점에서.
이 구조는 원자들이 동일한 장거리 패턴에 따라 정렬되기 때문에 결정질이다. 따라서, 그 단일 셀은 능 면체 결정 시스템에 상응한다 (상부 이미지에서와 동일). 따라서 모든 Au2O3 단위 세포의 모든 구체가 우주에 분배 되었다면 지어 질 수 있었다..
전자적 측면
금은 전이 금속이며 5d 궤도가 산소 원자의 2p 궤도와 직접 상호 작용할 것으로 예상됩니다. 이 궤도의 겹침은 이론적으로 전도대를 발생시켜 Au2O3 고체 반도체.
따라서 Au의 실제 구조2O3 이것을 염두에두고 훨씬 더 복잡하다..
수화물
금 산화물은 능 면체 결정 내에 물 분자를 보유 할 수있어 수화물이 생성됩니다. 이러한 수화물이 형성되면, 구조는 비정질이되고, 즉 무질서하게된다..
이러한 수화물에 대한 화학식은 다음과 같을 수 있으며 실제로는 명확히 밝혀지지 않았다. Au2O3∙ zH2O (z = 1, 2, 3 등), Au (OH)3, 또는 AuxO및(OH)z.
화학식 Au (OH)3 상기 수화물의 진정한 조성의 단순화를 나타낸다. 이는 금 수산화물 (III) 내에서 연구자들이 Au2O3; 그러므로, 그것을 "단순한"전이 금속 수산화물로서 고립으로 취급하는 것이 합리적이다.
한편, 화학식이 Au 인 고체xO및(OH)z 비정질 구조가 예상 될 수있다. 왜냐하면 이것은 계수에 의존하기 때문에 x, 및 및 z, 그 변이가 결정형 패턴을 거의 나타낼 수없는 모든 종류의 구조를 야기 할 것이다.
등록 정보
외관
붉은 갈색의 고체이다..
분자 질량
441.93 g / mol.
밀도
11.34 g / mL.
융점
160ºC에서 녹고 분해됩니다. 따라서 끓는 점이 없으므로이 산화물은 결코 비등점에 도달하지 않습니다.
안정성
Au2O3 처음에 언급했듯이, 금은 상온 조건에서 산화되지 않으므로 열역학적으로 불안정합니다. 그래서 그것은 다시 고귀한 금이되기 위해 쉽게 감소됩니다..
온도가 높을수록 열 분해로 알려진 반응이 빠릅니다. 그래서, Au2O3 160 ° C에서 분해되어 금속성 금을 생성하고 분자 산소를 방출합니다 :
2 Au2O3 => 4 Au + 3 O2
상기 환원을 선호하는 다른 화합물과 매우 유사한 반응이 발생할 수있다. 왜 감소? 금은 산소가 그것에게서 가지고 간 전자를 얻기 위하여 돌려 보내기 때문에; 그것은 산소와의 연결 고리를 잃는다는 것과 같은 말입니다..
용해도
그것은 물에 녹지 않는 고체이다. 그러나 염화 금 및 질산염의 형성으로 염산 및 질산에 용해된다..
명명법
산화 금 (III)은 주식 명명법에 의해 규율되는 이름입니다. 언급 할 수있는 다른 방법은 다음과 같습니다.
-전통적인 명명법 : aureric oxide, 원자가 3+가 금에 가장 높기 때문에.
-체계적인 명칭 : dioro trioxide.
용도
안경 색칠
가장 주목할만한 용도 중 하나는 안경과 같은 특정 재료에 붉은 색을 제공하는 것뿐만 아니라 금 원자에 고유 한 특정 성질을 부여하는 것입니다..
aurates 및 fulminating 금의 합성
금이 추가되면2O3 가용성 인 매질에 첨가하고, 금속의 존재하에, 강염기는 강염기를 첨가 한 후 침전 될 수있다; AuO 음이온에 의해 형성되는4- 금속 양이온 회사에서.
또한, Au2O3 암모니아와 반응하여 금 중합물, Au2O3(NH3)4. 그 이름은 폭발성이 높다는 사실에서 비롯된 것입니다.
자기 조립 단분자층의 취급
금과 그 산화물에서, 디 알킬 디술 피드 (RSSR)와 같은 특정 화합물은 동일한 방식으로 흡착되지 않습니다. 이 흡착이 일어날 때, Au-S 결합이 자발적으로 형성되며, 여기서 황 원자는 그것이 결합되는 작용기에 따라 상기 표면의 화학적 특성을 나타내고 정의한다..
RSSR은 Au에 흡착 할 수 없다.2O3, 그러나 금속 금에. 따라서, 금의 표면과 그 산화 정도가 변경되면, Au의 입자 또는 층의 크기2O3, 보다 이질적인 표면을 설계 할 수있다..
이 표면 Au2O3-AuSR은 특정 전자 장치의 금속 산화물과 상호 작용하여 미래의 똑똑한 표면을 개발합니다..
참고 문헌
- 위키 백과. (2018). 산화 금 (III). 원본 주소 'en.wikipedia.org'
- 화학 제제 (2018). 산화 금 (III). 에서 회복 된 : formulacionquimica.com
- D. Michaud. (2016 년 10 월 24 일). 금 산화물. 911 금속 학자. 원본 주소 '911metallurgist.com'
- Shi, R. Asahi 및 C. Stampfl. (2007). 금 산화물 Au의 특성2O3 및 Au2O : 우선 원칙 조사. 미국 물리 학회.
- Cook, Kevin M. (2013). Regioselective 표면 화학에 대한 마스킹 층으로서의 금 산화물. 논문과 논문. 종이 1460.


