망간 산화물 (MnO2) 화학 구조, 특성 및 용도
그 망간 산화물 (MnO2)는 산화수가 +4 인 산소와 망간 원소로 형성되는 무기 화합물이며, 산화물의 형성시 산화수는 -2이다. 또한 산화 망간 (IV)과 무수 망간.
그것은 어둡고 검은 색 커피에서 고체입니다. 흑색 및 결정화 된 수상 돌기 (분지 연신)를 형성하는 것은 광물 인 피로 사이트 (pyrolusite)와 같은 성격을 띠고있다. 과망간산 칼륨의 산화 작용에 의해 글리콜이 생성 된 후 에틸렌과 과망간산 칼륨 사이의 반응에서 흑색 잔류 물로서 얻어 질 수있다.

그것은 산화제의 특성으로 인해 유리 산업에서 매우 중요합니다. 왜냐하면 철 화합물에서 나오는 녹색을 제거하고이를 철.
색인
- 1 화학 구조
- 2 속성
- 3 용도
- 3.1 촉매제로서
- 4 건강에 미치는 영향
- 5 참고
화학 구조
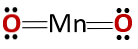
화합물의 화학 구조는 무수물의 화학 구조에 상응하고 염기성 산화물의 화학 구조에 상응하지 않는다. 이는 금속과 비금속으로 구성되어 있기 때문이다.
이 특별한 경우는 망간이 가지고있는 다양한 산화 상태에서의 행동 때문입니다. 따라서, 산화 상태 +2 및 +3은 산화물 MnO 및 Mn을 형성한다2O3 물과 반응 할 때 이들은 각각 망간 수산화물 및 망간 수산화물을 형성한다.
그러나, Mn2O3 약간 산성 인 매질에서 그것은 무수물처럼 행동한다. 산화 상태가 +4, +6 및 +7 인 경우, MnO2, MnO3 및 MnO4 그들은 물과 반응 할 때 산을 형성한다..
약간 산성 인 매질에서 MnO2 그것은 염기성 산화물처럼 행동하므로 대응하는 수산화물을 형성 할 수있다..

이 경우 화합물이 산성 또는 염기성으로 작용할 수있는 양성 특성에 대한 언급이 없음을 명심해야합니다. 이것은 Mn 거동의 특별한 경우이다..
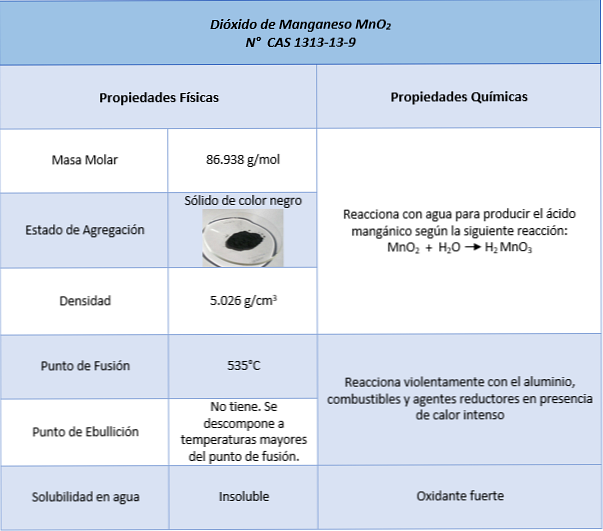
등록 정보
용도
- 그것은 망간의 소스로 사용됩니다
- 알카라인 배터리의 산화제로서
- 유리, 세라믹 및 도자기 용 페인트.
- 염소 및 요오드를 얻는 데있어서.
- 기체 산소 및 물의 형성을위한 과산화수소의 분해에서.
- 기체 산소 및 염화칼륨 생산을위한 염소산 칼륨의 분해 반응.
- 아세톤 또는 디클로로 메탄에 용해시켜 1 급 알콜을 알데히드로 산화시키고 케톤에는 2 급 알콜을 산화시킨다..
- 알카라인 배터리 제조.
촉매제로서
이것은 산화물 환원 반응, H와 같은 황화물 제거2S와 Fe 같은 양이온+2 및 Mn+2 , 이 유형의 화합물에 의해 오염 된 지하수에서 발견되는 비소 및 라디오.
이러한 오염은 독성 물질의 통제되지 않은 투기, 오염 된 토양의 세척 또는 물 추출시 화학 원소의 존재에 의해 발생 될 수있다.
MnO2 필터 (Filox)로 사용되는 pyrolusite에서 얻은 고순도는 지하수에서이 종류의 불순물을 제거하는 가장 효과적인 수단입니다.
건강에 미치는 영향
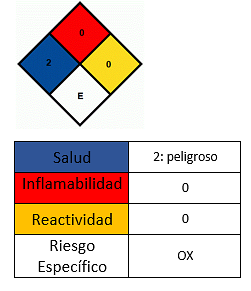
- 피부와의 접촉을 피하십시오..
- 접촉 한 경우 해당 부위를 씻으십시오..
- 분말을들이 마시지 마십시오..
- 눈 접촉시 자극과 홍조가 나타날 수 있습니다. 물로 충분히 씻어 내고 눈을 통해 물이 흐르도록하여 심각한 경우 의료 조치를 요청하십시오..
- 피부에 접촉시 자극과 적색이 관찰됩니다. 영향을받은 부위를 물과 비누로 충분히 씻어 내십시오..
- 피부 접촉을 장기간 지속하면 자연 지방이 제거되어 피부염을 유발합니다..
- 흡입하면 독감과 유사한 증상이 나타날 수 있습니다 (금속성 연무). 이 상태는 고열, 오한, 구강 건조 및 목구멍, 근육통 및 두통이 특징입니다.
- 그것은 호흡 기관을 자극하고 호흡기 감염 (폐렴)의 발병률을 높일 수 있습니다. 폐를 통한 무기 망간 염의 흡수에 의한 중독은 거의 발생하지 않지만 만성 중독이 발생할 수 있습니다.
- 장기간에 걸친 이산화 망간의 먼지 나 연기에 만성적으로 노출되면 중추 신경계에 영향을 주어 파킨슨 병의 발달, 걷기 장애, 근육 경련 및 행동 변화를 일으킬 수 있습니다.
- 섭취하면 복통과 메스꺼움을 유발할 수 있음..
- 가연성 물질은 아니지만 백열 물질에 불을 퍼뜨리는 데 도움이됩니다. 535 ° C 이상의 온도로 가열하면 물질은 산화 망간 (III)으로 분해된다. Mn2O3 산소는 인화성이며 화재의 위험을 증가시킵니다. 이 경우 화재는 거품 또는 이산화탄소로 소화되어야한다..
- 누출 된 경우 적절한 개인 보호 장치없이 화합물을 조작하지 마십시오..
- 차고 건조한 장소에 밀폐 된 용기에 보관하고 유기 물질 및 가연성 물질과 같은 부적합 물질과 분리하여 보관하십시오.
- 보관 장소는 건조해야하며 산성 부식에 잘 견디고 배수가 잘되는 바닥이 있어야합니다..
- 장갑, 안전 안경, 증기 필터 마스크, 먼지 및 연기와 같은 개인 보호 장비를 사용해야합니다.
참고 문헌
- B, (2015), 망간 이산화물, 왕립 학회 - 화학 세계, chemistryworld.com에서 검색
- Karal, (2014), Mangneso Dioxide, 안전 데이터 시트, karal.com.mx에서 복구
- 가상 교사 (2015-02-25). 망간 무기 화합물 (특수 사례 1) - 이론 수업), youtube.com에서 검색
- Ecured, (s.f), 망간 이산화물, ecured.cu에서 회복 됨
- Angarita G, Johnny., (2017), Manganese Dioxide : 뛰어난 기술. 하이드로 테크, hydrotecocr.com에서 복구
- Fernández, G., (2015), MnO Manganese Dioxide2/ 아세톤, 유기 화학, quimicaorganica.net에서 회복
- Tronox, (2011), 망간 이산화물, 안전 데이터 시트, from tronox.com


