칼슘 산화물 (CaO) 구조, 재산 및 용도
그 산화 칼슘 (CaO)는 칼슘과 산소를 이온 형태로 함유하는 무기 화합물이다 (과산화 칼슘, CaO2). 그것은 탄산염, 산화 칼슘 및 수산화물뿐만 아니라 규소, 알루미늄 및 철과 같은 다른 금속을 포함하는 무기 화합물을 나타내는 단어 인 석회로 전 세계적으로 알려져 있습니다..
이 산화물 (또는 석회)은 수화 유무에 따라 생석회 또는 소석회라고도합니다. 석회는 산화 칼슘이며 소석회는 수산화물입니다. 차례로, 석회석 (석회석 또는 경화 된 석회)은 실제로 탄산 칼슘 (CaCO3).

그것은 칼슘의 가장 큰 천연 자원 중 하나이며 산화 칼슘 생산을위한 원료를 구성합니다. 이 산화물은 어떻게 생성 되는가? 탄산염은 열분해되기 쉽다. 탄산 칼슘을 825 ℃ 이상의 온도에서 가열하여 석회와 이산화탄소를 형성시킨다..
위의 문장은 다음과 같이 설명 할 수 있습니다 : CaCO3(s) → CaO (s) + CO2(g) 지구의 지각은 석회석과 방해석이 풍부하기 때문에 바다와 해변에는 풍부한 바다 포탄 (산화 칼슘 생산을위한 원료), 산화 칼슘은 상대적으로 저렴한 시약.
색인
- 1 공식
- 2 구조
- 3 속성
- 3.1 용해도
- 4 용도
- 4.1 모르타르로서
- 4.2 안경 제작시
- 4.3 광업에서
- 4.4 규산염 제거제로서
- 5 산화 칼슘 나노 입자
- 6 참고 문헌
수식
산화 칼슘의 화학 화학식은 CaO이고, 칼슘은 산 이온 (전자 수용체)과 유사합니다. Ca2+, 염기성 이온 (전자 공여체)으로서 산소 및2--.
칼슘이 +2 차지하는 이유는 무엇입니까? 칼슘은 주기율표의 2 군 (Becambara)에 속하고 산소 원자를 생성하는 결합을 형성 할 수있는 2 개의 원자가 전자만을 가지고 있기 때문에.
구조
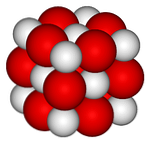
위 이미지에는 산화 칼슘의 결정 구조 (gem-salt type)가 표시되어있다. 부피가 큰 붉은 구체는 칼슘 이온2+ 그리고 하얀 구가 이온들 O2-.
이 입방체 배열에서 각 이온 Ca2+ 6 개의 이온으로 둘러싸인 O2-, 그들 사이에있는 큰 이온들에 의해 남겨진 팔면체 구멍들에서 폐색.
이 구조는이 산화물의 이온 특성을 최대로 표현하지만, 반지름의 현저한 차이 (흰색 영역보다 큰 빨간색 구체)가 MgO와 비교할 때 약한 결정 격자 에너지를 부여합니다.
등록 정보
물리적으로 결정 성 백색 고체이며, 무취이며, 강한 융점 (2572 ℃)과 끓는점 (2850 ℃)에 대한 강한 정전기 상호 작용을합니다. 또한, 이는 55,958g / mol의 분자량 및 열 발광성의 흥미로운 특성을 갖는다.
이것은 화염에 노출 된 칼슘 산화물 조각이 강렬한 백색광으로 빛날 수 있음을 의미합니다. 영어로 이름이 알려져 있습니다. 각광, 또는 스페인어로, 칼슘의 빛. Ca 이온2+, 화재와 접촉하여 다음 그림과 같이 붉은 불꽃을 일으킨다..

용해도
CaO는 수분을 흡수하는 정도 (흡습성이있는 고체 임)로 소석회 또는 수산화칼슘을 즉시 생산하도록 반응하여 물에 대한 친 화성이 강한 염기성 산화물입니다.
CaO (s) + H2O (1) => Ca (OH)2(들)
이 반응은 더 강한 상호 작용 및보다 안정한 결정 격자를 갖는 고체의 형성으로 인해 발열 (열 방출)된다. 그러나, Ca (OH)가 가열되면 반응은 가역적이다.2, 그것을 탈수시키고 점토질 석회를 점화하는 것; 그 다음, 석회는 "다시 태어났다".
생성 된 용액은 매우 염기성이며, 산화 칼슘으로 포화 된 경우 pH는 12.8에 이릅니다..
마찬가지로, 그것은 글리세롤 및 산 및 설탕 용액에 용해된다. 그것은 기본 산화물이기 때문에, 그것은 산성 산화물 (SiO2, 알2O3 신앙2O3, 예를 들어, 액체 상태에서 가용성). 한편, 알콜 및 유기 용매에는 불용성이다.
용도
CaO는 아세틸렌 (CH≡CH)의 합성뿐만 아니라 폐수에서 나오는 인산염의 추출 및 기체 폐기물로부터의 이산화황과의 반응에서 많은 산업적 용도를 가지고있다..
산화 칼슘의 다른 용도는 다음과 같습니다 :
박격포로
산화 칼슘이 모래 (SiO2)과 물, 케이크와 함께 모래와 물과 천천히 반응하여 소석회를 형성합니다. 차례로, CO2 의 공기는 물에 용해되고 소금과 반응하여 탄산 칼슘을 형성한다.
Ca (OH)2(s) + CO2(g) => CaCO3(s) + H2O (l)
CaCO3 모르타르 (이전 혼합물)가 벽돌이나 블록 또는 도자기를 경화 시키거나 원하는 표면에 고정시키는 원인이되는 CaO보다 더 저항력이 높고 단단한 화합물입니다.
안경 생산
유리 제조에 필수적인 원료는 산화 규소이며 석회, 탄산나트륨 (Na2콜로라도 주3) 및 기타 첨가제를 가열 한 다음 유리질 고체로 만듭니다. 이 고체는 연속적으로 가열되고 어떤 숫자로 날려.
광업에서
소석회는 수소 결합 (O-H-O) 상호 작용으로 인한 생석회보다 더 많은 용적을 차지합니다. 이 속성은 내부에서 암석을 깨는 데 사용됩니다..
이것은 석회와 물의 조밀 한 혼합물로 그들을 채우는 것에 의해 달성된다, 그것은 바위에서 그 열과 팽창성의 힘에 집중하기 위해 봉해진다.
규산염 제거제로서
CaO는 실리케이트와 융합되어 유착 액을 형성하고, 그 후 특정 제품의 원료로부터 추출된다.
예를 들어, 철광석은 금속 철과 강철을 생산하기위한 원료입니다. 이러한 미네랄은 공정에서 바람직하지 않은 불순물 인 규산염을 함유하고 있으며 방금 설명한 방법으로 제거됩니다.
산화 칼슘 나노 입자
산화 칼슘은 나노 입자로서 합성 될 수 있으며, 질산 칼슘 (Ca (NO3)2) 및 용액 중 수산화 나트륨 (NaOH).
이 입자는 구형, 기본 (거시적 인 고체)뿐만 아니라 많은 표면적을 가지고 있습니다. 결과적으로, 이러한 특성은 촉매 공정에 도움이됩니다. 어느 쪽? 조사가 현재 그 질문에 대답하고 있습니다..
이러한 나노 입자는 인공 광합성, 중금속 및 유해 금속으로부터의 물의 정제를위한 화학적 변형을 수행하기위한 신약의 제형에서 치환 된 유기 화합물 (피리딘 유래)을 합성하는데 사용되어왔다. 광촉매.
나노 입자는 파파야 및 녹차의 잎과 같은 생물학적 지지체상에서 합성되어 항균제로 사용될 수있다.
참고 문헌
- scifun.org (2018). 석회 : 산화 칼슘. 2018 년 3 월 30 일에 검색된 곳 : scifun.org.
- 위키 백과. (2018). 산화 칼슘. 2018 년 3 월 30 일에 가져온 사람 : en.wikipedia.org
- Ashwini Anantharaman et al. (2016). 산화 칼슘 나노 입자의 녹색 합성과 응용 공학 연구 및 응용의 저널. ISSN : 2248-9622, Vol.6, Issue 10, (Part -1), pp.27-31.
- J. Safaei-Ghomi et al. (2013). 산화 칼슘 나노 입자는 수성 에탄올 배지에서 고도로 치환 된 피리딘의 1 단계 다 성분 합성을 촉매 하였다. Scientia Iranica, Transactions C : Chemistry and Chemical Engineering 20 549-554.
- PubChem. (2018). 칼슘 산화물. 2018 년 3 월 30 일에 검색 한 사람 : pubchem.ncbi.nlm.nih.gov
- Shiver & Atkins. (2008). 무기 화학 있음 그룹 2의 요소들. (제 4 판, 280 쪽). Mc Graw Hill.


