붕소 산화물 (B2O3) 구조, 특성, 명명법 및 용도
그 붕소 산화물 또는 붕산 무수물은 화학식이 B 인 무기 화합물이다2O3. 주기율표의 p 블록의 붕소 및 산소 원소, 그리고 각각의 그룹의 더 많은 머리로서, 이들 사이의 전기 음성도의 차이는 그리 높지 않다; 그러므로 B가2O3 본질적으로 공유 적이다..
The B2O3 용융로 내에서 750 ℃의 온도에서 진한 황산에 붕사를 용해시켜 제조한다. 열 탈수 붕산, B (OH)3, 약 300 ℃의 온도에서; 또는 디보 란 반응의 생성물로서 형성 될 수있다 (B2H6) 산소.

붕소 산화물은 반투명 한 유리 또는 결정 모양을 가질 수 있습니다. 후자는 분말 형태로 분쇄하여 얻을 수 있습니다 (상단 이미지).
처음에는 보이지 않을 수도 있지만 B2O3 가장 복잡한 무기 산화물 중 하나로; 구조적인 관점 에서뿐만 아니라 안경과 도자기가 획득하는 다양한 속성 때문에 매트릭스에 추가됩니다.
색인
- 1 산화 붕소의 구조
- 1.1 단위 BO3
- 1.2 결정 구조
- 1.3 유리 구조물
- 2 속성
- 2.1 외관
- 2.2 분자 질량
- 2.3 맛
- 2.4 밀도
- 2.5 융점
- 2.6 끓는점
- 2.7 안정성
- 3 명칭
- 4 용도
- 4.1 삼 할로겐화 붕소의 합성
- 4.2 살충제
- 4.3 금속 산화물의 용매 : 유리, 세라믹 및 붕소 합금의 형성
- 4.4 바인더
- 5 참고
붕소 산화물의 구조
BO 장치3
The B2O3 는 공유 결합 고체이므로 이론 상으로는 구조 내에 B 이온이 없다3+ O도2-, 그러나 B-O 링크. 붕소는 원자가 결합 이론 (VTE)에 따라 단지 3 개의 공유 결합을 형성 할 수있다. 이 경우, 3 개의 B-O 링크. 결과적으로, 예상 된 기하학은 삼각 형이어야하며, BO3.
BO 분자3 그것은 전자, 특히 산소 원자가 결핍되어있다. 그러나 그들 중 몇 명은 서로 상호 작용하여 결핍을 공급할 수 있습니다. 그래서, 삼각형 BO3 그들은 산소 다리를 공유함으로써 합류하고, 그것들은 비행기를 다른 방향으로 향한 삼각형의 행 네트워크로서 우주 공간에 분포한다.
결정 구조
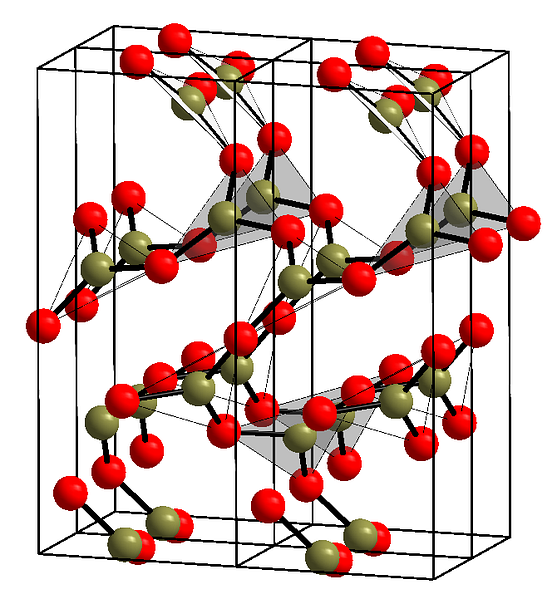
상부 이미지는 삼각형 단위 BO를 갖는 상기 행의 예를 도시한다3. 신중하게 보면면의 모든면이 독자를 향하지 만 다른면은 아닙니다. 이 얼굴들의 방향은 B가 어떻게 정의되는지에 대한 책임이있다.2O3 특정 온도 및 압력에서.
이러한 네트워크가 장거리 구조 패턴을 가지면 결정 성 고체이며 단위 셀에서 구성 할 수 있습니다. B가 말한 곳입니다.2O3 그것은 2 개의 결정질 다 형체를 갖는다 : α와 β.
α-B2O3 주변 압력 (1 기압)에서 발생하며, 동역학 적으로 불안정하다고한다. 실제로 이것은 산화 붕소가 어려운 결정화의 화합물 일 가능성이 높은 이유 중 하나이다..
다른 다 형체 β-B2O3, 그것은 GPa 범위의 고압에서 얻어진다; 그러므로, 그것의 밀도는 α-B의 밀도보다 커야한다.2O3.
유리 구조물
네트워크 BO3 자연적으로 그들은 비정질 구조를 채택하는 경향이있다. 이것들은 고체 안에있는 분자 나 이온을 설명하는 패턴이 없습니다. B를 합성함으로써2O3 그것의 우세한 형태는 무정형이며 결정질이 아니다. 올바른 말로 표현하자면, 결정질보다 유리질이 더 깁니다..
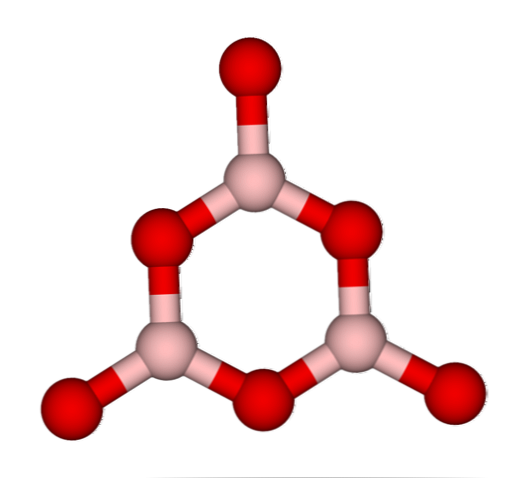
그렇다면 B2O3 그것의 BO 네트워크가 유리질이거나 무정형 일 때3 그들은 지저분 해. 뿐만 아니라 이것들은 함께 오는 길을 변화시킵니다. 삼각 기하학으로 배치되는 대신 연구원들이 보록 솔린 (boroxol) 링 (top image)이라고 부르는 것을 만들도록 연결됩니다..
삼각형과 육각형 단위의 명백한 차이점에 유의하십시오. 삼각형은 B를 특징 짓는다.2O3 B에 결정체 및 육각형2O3 유리질의 이 비정질 상을 언급하는 또 다른 방법은 붕소 유리 또는 화학식 : g-B이다.2O3 ( 'g'는 글래시라는 단어에서 온다.).
따라서, G-B 네트워크2O3 그들은 보 로크 졸 고리로 이루어져 있고 BO 단위는 아닙니다3. 그러나, g-B2O3 α-B로 결정화 될 수있다.2O3, 고리의 삼각형에 대한 상호 변환을 암시하며, 또한 달성 된 결정화 정도를 정의한다.
등록 정보
외관
무색이며 유리질의 고체입니다. 그것의 결정 형태로 그것은 백색이다..
분자 질량
69.6182 g / mol.
맛
약간 쓰라린
밀도
-결정질 : 2.46 g / mL.
-유리 : 1.80g / mL.
융점
그것이 결정체 또는 유리질에 달려 있기 때문에 그것은 완전히 정의 된 녹는 점이 없습니다. 순수한 결정 형태는 450 ° C에서 녹습니다. 그러나 유리 형태는 300 ~ 700 ℃ 범위의 온도에서 녹습니다.
끓는점
다시보고 된 값은이 값과 일치하지 않습니다. 명백하게 액체 붕소 산화물 (결정 또는 유리에서 용해)은 1860ºC.
안정성
수분을 흡수하여 붕산 B (OH)3.
명명법
붕소 산화물은 다음과 같은 다른 방법으로 명명 될 수 있습니다.
-Diboro trioxide (체계적인 명명법).
-산화 붕소 (Ⅲ) (스톡 n 멘토).
-산화 붕소 (전통적인 명명법).
용도
산화 붕소의 용도 중 일부는 다음과 같습니다.
삼 할로겐화 붕소의 합성
B부터2O3 붕소 트리 할라이드, BX 합성 될 수있다.3 (X = F, Cl 및 Br). 이들 화합물은 루이스 산이며, 이들과 함께 새로운 특성을 갖는 다른 유도체를 얻기 위해 특정 분자에 붕소 원자를 도입하는 것이 가능하다.
살충제
붕산과의 고체 혼합물, B2O3-B (OH)3, 국내 살충제로 사용되는 공식을 나타냅니다..
금속 산화물의 용매 : 유리, 세라믹 및 붕소 합금의 형성
액체 붕소 산화물은 금속 산화물을 용해시킬 수 있습니다. 이 생성 된 혼합물로부터, 일단 냉각되면, 붕소 및 금속.
B의 양에 따라2O3 기술, 금속 산화물의 종류뿐만 아니라 다양한 종류의 유리 (붕 규산염), 도자기 (질화물 및 붕소 탄화물) 및 합금 (금속 만 사용되는 경우)을 얻을 수 있습니다..
일반적으로 유리 또는 세라믹은 더 큰 강도와 강도는 물론 더 큰 내구성을 얻습니다. 안경의 경우 광학 렌즈와 망원경, 전자 장치에 사용됩니다..
바인더
철강 용해로의 건설에 마그네슘 기반의 내화 벽돌이 사용됩니다. 그 (것)들에서, 붕소 산화물은 바인더로 이용되고, 그 (것)들을 단단히 묶는 유지하는 것을 돕는다.
참고 문헌
- Shiver & Atkins. (2008). 무기 화학 (제 4 판). Mc Graw Hill.
- 위키 백과. (2019). 삼산화 붕소. 원본 주소 'en.wikipedia.org'
- PubChem. (2019). 붕산염. 원본 주소 'pubchem.ncbi.nlm.nih.gov'
- 리오 틴토. (2019). 산화 붕소 20 뮬 팀 붕사 원본 주소 'borax.com'
- A. Mukhanov, O.O. Kurakevich 및 V. L. Solozhenko. (s.f.). 붕소 (III) 산화물의 경도. LPMTMCNRS, Universite Paris Nord, 빌레 야 네우스, 프랑스.
- Hansen T. (2015). B2O3 (붕산염). 원본 주소 'digitalfire.com'


