구리 황화물 속성, 위험 및 용도
그 황화 구리 Cu 화합물을 가진 화합물과 미네랄을 기술한다.xS및. 이러한 화합물은 경제적으로 중요한 미네랄 및 합성 물질을 포함합니다..
가장 눈에 띄는 황화 구리 광물은 황화 구리 (I) 또는 황화 제일 구리를 포함합니다.2코발트 광물에서 발견되는 CuS 공식의 황산 구리 (II) 또는 구리 황화물에서 발견되는 S.
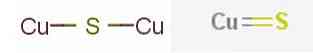
Calcosine은 수세기 동안 추출되어 가장 수익성이 높은 구리 광석 중 하나입니다. 이유는 높은 구리 함량 (원자 비율 67 % 및 거의 80 % 중량)과 구리가 황으로부터 분리 될 수있는 용이성 때문입니다.
그러나 희소 때문에 주요 구리 광물이 아닙니다. 가장 부유 한 calcosine 매장지가 채굴되었지만, 아직 채광되고 있으며, 앞으로도 채굴 될 것입니다. (광산 채굴권, 2014).

Covelite는 분산 된 광물이 아니지만, 그 무지개 빛깔의 매력은 남색의 결정을 보는 사람의 감탄을 사로 잡을 수 있습니다. 좋은 결정체는 드물지만,이 미네랄의 광택과 색이 놀랍습니다 (미네랄 COVELLITE, 2014 년).

광산업에서, 혼합 된 구리 및 철 황화물로 구성되는 용골 광석 또는 칼 코파 라이트 광물은 흔히 "구리 황화물".
화학에서 "2 성분 구리 황화물"은 구리와 황 원소의 2 원 화합물입니다. 구리 황화물은 그 원천이 무엇이든 수많은 비 화학 양 론적 화합물을 포함하여 0.5≤Cu / S≤2와 함께 조성이 다양하다.
색인
- 1 구리 황화물의 물리적 및 화학적 특성
- 2 반응성 및 위험성
- 3 용도
- 4 참고
구리 황화물의 물리 화학적 성질
황화 구리 (I)와 황화 구리 (II)는 비슷한 외관을 띠고 있으며, 어두운 색, 회색 또는 검은 색.

이들 화합물은 그 결정 구조에 의해 구별 될 수있다. 황화 구리 (I)는 단사 결정 구조를 가지지 만 황화 구리 (II)는 육각형 구조를 갖는다 (National Center for Biotechnology Information, S.F.).
159.16 g / 몰 및 95,611g / 몰의 분자량 및 5.6 g / ㎖ 및 4.76의 밀도 g / ㎖ 황화 구리 (I)와 대 (II)는 각각 (국립 센터의 경우 생명 공학 정보, SF).
황화 구리 (I)는 융점이 1100 ° C이고 물과 아세트산에 용해되지 않으며 수산화 암모늄에 부분적으로 용해됩니다 (Royal Society of Chemistry, 2015).
황화 구리 (II)는 그 분해 220 ℃의 융점을 가지며, 물, 염산 및 황산에 불용성 인 질산 암모늄, 수산화 칼륨, 시안화 (화학 로얄 학회 2015에 가용성 ).
과산화수소는 황화 구리 (II)와 격렬하게 반응하며 염소산 또는 카드뮴, 염소산 마그네슘 또는 염화 아연의 농축 용액과의 접촉시 폭발합니다.
반응성 및 위험성
인해 황화수소의 생산에 섭취 한 경우 구리 황화물 (I) 및 (II)가 위험물로 분류되지 않고, 그러나, 독성 일 수있다. 증상은기도에 자극을 일으킬 수 있습니다 (물질 안전 보건 자료 (MSDS) 구리 황화물, 1995) 피부와 눈과 흡입에 자극을 일으킬 수, 구토, 위 통증과 현기증을 포함.
열에 노출되면 건강에 해를 끼칠 수있는 황 또는 산화 구리의 독성 증기를 방출 할 수 있음.
눈에 닿은 경우 즉시 충분한 양의 물로 15 분간 씻어 내고 때때로 눈꺼풀을 들어 올리십시오..
피부에 접촉 된 경우 오염 된 옷을 벗고 15 분 동안 충분한 양의 물로 즉시 씻어 내십시오..
섭취의 경우, 독극물 관리 센터를 즉시 호출해야합니다. 차가운 물로 입을 헹구고 피해자에게 1-2 컵의 물이나 우유를 마시 게하십시오. 즉시 구토를 유도해야합니다..
흡입의 경우, 피해자는 시원한 장소로 이동해야합니다. 호흡하지 않을 경우 인공 호흡을 실시하십시오 (Copper (II) Sulfide, 2009).
용도
황화 구리 (I)는 반도체 및 사진 응용 분야 (americanelements, 1998-2017)에 사용됩니다. 태양 전지, 발광성 도료, 전극 및 특정 종류의 고체 윤활제 (Britannica, 2013)의 용도도 포함됩니다..
또한, 황화 구리 (II)가 태양 전지에 응용 superionic 도체, 광 검출기, 도전성 전극, 능동 전파, 가스 센서 및 편광판 방사선 흡수 장치 광열 변환 보호막 마이크로파 발견 적외선 (azom, 2013).
또한 구리 (II) 황화물 (covelite)은 나노 입자의 연구에 사용됩니다 :
- 다른 제조 절차 (solvothermal 경로, 에어로졸 방법, 솔루션 방법 및 thermolysis)
- 및 애플리케이션 (광촉매 분해 암세포의 절제, 리튬 이온 전지, 가스 센서, 전계 방출 특성, 전극 재료, 수퍼 커패시터 애플리케이션, 광전기 성능 QDSCs, 유기 오염 물질의 광촉매 감소 바이오 전기 화학적 검출, 미리 요리 된 CuS 필름 전극의 개선 된 PEC 특성) (Umair Shamraiz, 2016).
연구에서 Geng 구 (2012)와 그를 찾아 음향 단층 표시하는 황화 구리 나노 입자의 반도체 (CUS 된 NP)의 사용을 증명 : YAG를 1,064 ㎚의 파장에서.
기분이야 순이익은 두개 내 주사 후 마우스 뇌의 시각화를 허용, 림프 근육 닭 가슴살에 포함 된 간질 주입하고 기분이야 NP를 포함하는 아가 로스 젤 후 피부 아래 12mm에 쥐 노드 ~ 5 cm의 깊이에서. 이 이미지 접근법은 유방암의 분자 이미지를 얻을 수있는 큰 가능성을 가지고 있습니다.
참고 문헌
- (1998-2017). 구리 (I) 황화물. americanelements.com에서 검색 함.
- (2013 년 4 월 19 일). 구리 황화물 (CuS) 반도체. azom.com에서 가져옴.
- Britannica, T. E. (2013 년 8 월 23 일). 구리 (Cu). britannica.com에서 검색 함.
- 구리 (II) 설파이드. (2009, 1 월 23 일). onboces.org에서 검색 함.
- Geng Ku, M. Z. (2012). 1064 nm에서 딥 티슈 이미징을위한 광청 조영제의 새로운 부류로서 황화 구리 나노 입자. ACS Nano 6 (8), 7489-7496.
- 물질 안전 보건 자료 구리 황화물. (1995, 11 월). onboces.org에서 검색 함.
- 생명 공학 정보 센터. (S.F.). PubChem 복합 데이터베이스; CID = 14831. pubchem.ncbi.nlm.nih.gov에서 가져옴.
- 생명 공학 정보 센터. (S.F.). PubChem 복합 데이터베이스; CID = 62755. pubchem.ncbi.nlm.nih.gov에서 가져옴.
- 화학 왕립 학회. (2015). 구리 (II) 설파이드. chemspider.com에서 가져온.
- 화학 왕립 학회. (2015). Dicopper (1+) sulfide. chemspider.com에서 가져온.
- 미네랄 CHALCOCITE. (2014). galleries.com에서 검색 함.
- 미네랄 위성. (2014). galleries.com에서 검색 함.
- Umair Shamraiz, R. A. (2016). 황화 구리 (CuS) 나노 구조의 제조 및 응용. 저널 고체 화학 체적 238, 25-40.


