알루미늄 황화물 (Al2S3) 화학 구조, 명칭, 속성
그 알루미늄 황화물 (Al2S3) 마지막 에너지 준위의 전자를 잃어 양이온이되어 금속 알루미늄의 산화에 의해 형성되고, 알루미늄에 의해 생성 된 전자를 얻고 비금속 황을 환원시킴으로써 형성되는 밝은 회색 화합물입니다. 음이온.
이것이 일어나고 알루미늄이 그것의 전자를 산출 할 수 있으려면, 3 개의 하이브리드 궤도 sp3, 유황으로부터 전자와 결합을 형성 할 수있는 가능성을주는.

알루미늄 황화물의 물에 대한 감도는 공기 중 수증기가있는 상태에서 반응하여 수산화 알루미늄 (Al (OH))을 생성 할 수 있음을 의미합니다.3), 황화수소 (H2S) 및 수소 (H2기체; 후자가 축적되면 폭발을 일으킬 수 있습니다. 따라서, 황화 알루미늄의 포장은 기밀 용기.
한편, 황화 알루미늄은 물과의 반응성을 가지므로, 상기 용매에 용해되지 않는 원소로된다.
색인
- 1 화학 구조
- 1.1 분자식
- 1.2 구조식
- 2 속성
- 2.1 물리적 특성
- 2.2 화학적 성질
- 3 용도 및 용도
- 3.1 수퍼 커패시터에서
- 3.2 2 차 리튬 전지
- 4 가지 위험
- 4.1 응급 처치 절차
- 4.2 소방 대책
- 5 참고
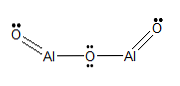
화학 구조
분자식
알2S3
구조식
- 황화 알루미늄.
- 디 알루미늄 트리 설파이드.
- 황화 알루미늄 (III).
- 황화 알루미늄.
등록 정보
화학 화합물은 대개 물리적 및 화학적 성질의 두 가지 종류의 특성을 나타냅니다.
물리적 특성
몰 질량
150,158g / mol
밀도
2.02 g / mL
융점
1100 ° C
물 용해도
불용성
화학적 성질
알루미늄 황화물의 주요 반응 중 하나는 물 또는 기질 또는 주요 시약과 같습니다 :

이 반응에서, 수산화 알루미늄 및 황화수소의 형성은 그것이 가스 또는 황화수소의 형태로 존재할 때 그것이 용액으로서 물에 용해되는 경우 관찰 될 수있다. 그것의 존재는 썩은 달걀 냄새에 의해 확인됩니다..
용도 및 용도
수퍼 커패시터에서
알루미늄 황화물은 특정 표면적 및 전기 전도성을 개선하는 나노 네트워크 구조의 제조에 사용되어 높은 커패시턴스 및 에너지 밀도가 달성 될 수있는 방식으로 슈퍼 커패시터의 적용이 가능합니다.
Graphene oxide (GO) - 그래 핀 (graphene)은 탄소 동족체 형태 중의 하나이며, 알루미늄 황화물 (Al2S3)을 수열 법으로 제조 한 나노 - 몬타나와 유사한 계층 적 형태로.
그라 핀 산화물 작용
높은 전기 전도도 및 표면적뿐만 아니라 지지체로서의 그래 핀 산화물의 특성은 나노 란탐 트 (nanorambutant) Al2S3 전기 화학적으로 활동적이다..
잘 정의 된 산화 환원 피크를 갖는 CV 비유 전율 곡선은 나노 럭 부탄 Al의 의사 용량 성 거동을 확인합니다2S3 계층 적이며 1M NaOH 전해질에서 그라 핀 산화물로 유지됨. 곡선으로부터 얻은 특정 CV 커패시턴스 값은 5mV / s의 스캔 속도에서 168.97.
또한, 903μs의 양호한 정전류 방전 시간이 관찰되었으며, 3mA / ㎝의 전류 밀도에서 2178.16의 큰 비유 전율이 관찰되었다2. 정전류 방전으로부터 계산 된 에너지 밀도는 3 mA / ㎝의 전류 밀도에서 108.91 Wh / Kg이다2.
따라서, 전기 화학적 임피던스는 계층 적 나노 - 허밍 전극 Al의 의사 - 용량 성을 확인한다2S3. 전극 안정성 테스트는 최대 1000 사이클의 비유 전율을 57.44 % 유지하는 것을 보여줍니다.
실험 결과는 나노 란탄 트란 Al2S3 계층 적 구조는 수퍼 커패시터 응용 분야에 적합합니다..
2 차 리튬 전지
높은 에너지 밀도를 갖는 리튬 2 차 전지를 개발하려는 의도로, 알루미늄 황화물 (Al2S3)를 활물질.
Al에서 측정 한 초기 방전 용량2S3 100 mA g-1에서 약 1170 mAh g-1이었다. 이는 이론적 인 유황 용량의 62 %에 해당합니다..
알2S3 주로 충전 공정 또는 Li 추출의 구조적 비가역성으로 인해 0.01V 내지 2.0V의 전위 범위에서 열악한 용량 보유율을 나타냈다..
알루미늄 및 황에 대한 XRD 및 K-XANES 분석은 Al2S3 로딩 및 언 로딩 프로세스 동안 가역적으로 반응하지만, Al 코어2S3 LiAl 및 Li가 구조적 비가역성을 나타내었기 때문에2S는 Al2S3 처음 다운로드 할 때 그들은 그대로 남아있었습니다..
위험
- 물과 접촉하면 자발적으로 연소 할 수있는 가연성 가스가 방출 됨.
- 피부에 자극을 일으킴..
- 눈에 심한 자극을 일으킴..
- 호흡기 자극을 일으킬 수 있음.
불순물, 첨가제 및 기타 요인에 따라 알림간에 정보가 다를 수 있습니다..
응급 처치 절차
일반 치료
증상이 지속되면 의료 조치를 취하십시오..
특별 대우
없음
중요한 증상
없음
흡입
피해자를 옥외로 데려가십시오. 호흡이 곤란한 경우 산소 공급.
섭취
하나 또는 두 개의 물컵을 관리하고 구토를 유도하십시오. 의식을 잃은 사람에게 구토를 유도하거나 입으로 아무것도주지 마시오..
피부
물과 순한 비누로 해당 부위를 씻으십시오. 오염 된 의복을 제거하십시오.
눈
물로 눈을 씻고 몇 분 동안 자주 깜박입니다. 콘택트 렌즈가 있으면 제거하고 계속 헹구십시오..
소방 대책
인화성
인화성이 없음.
소화제
물과 반응합니다. 물을 사용하지 마십시오 : CO2, 모래 및 소화 분말을 사용하십시오.
싸우는 절차
완전한 보호 장치가있는 전면 형 자 급식 호흡기를 사용하십시오. 피부 및 눈과의 접촉을 피하기 위해 의복 착용.
참고 문헌
- 건강, 위험 및 환경에 관한 Salud y Riesgos.com, (s.f), 정의, 개념 및 기사. 복구 됨 : saludyriesgos.com
- 황화 알루미늄. (s.f) Wikiwand에서. 2018 년 3 월 9 일에 검색 됨 : wikiwand.com
- 2018 년 3 월 10 일에 복구 된 Web Elements. (S.f) .Dialuminium Trisulpfide : webelements.com
- Iqbal, M., Hassan, M., M., Bibi.S., Parveen, B. (2017). 슈퍼 커패시터 적용을위한 합성 그라 펜 산화물 기반 계층 적 Al2S3 나노 밤 부탄의 높은 비 전기 용량 및 에너지 밀도, Electrochimica Acta, 246 권 ,1097-1103 페이지
- Senoh, H., Takeuchi, T., Hiroyuki K., Sakaebe, H., M., Nakanishi, K., Ohta, T., Sakai, T., Yasuda, K. (2010). 리튬 용 황화 알루미늄의 전기 화학적 특성.저널 파워 소스,제 195 권, Issue 24, Pages 8327-8330 doi.org
- LTS 연구소, Inc (2016), 안전 데이터 시트 알루미늄 황화물 : ltschem.com