나트륨 황산염 공식, 재산, 구조, 신청
그 황산나트륨 (황산의이 나트륨 염, 테트라 옥소 황산나트륨, 탄산염의 황산염, Glauber의 소금, thenardite, mirabilite)은 Na2그래서4 및 관련 수화물. 모든 형태는 물에 잘 녹는 흰색 고체입니다..
그것은 판매되는 주요 화학 제품 중 하나로 간주됩니다. 전 세계적으로 (거의 독점적으로 수 십수화물 형태로) 생산량은 연간 약 6 백만 톤에 이릅니다..

과 르당은 무수 황산나트륨 광물로서 건조한 동굴에서, 오래된 채굴 작업에서 백태로, 그리고 fumaroles 주변에 퇴적물로 생성되는 무수 황산 광물이다.
그것은 1825 년 Salinas Espartinas (Ciempozuelos, Madrid, Spain)에서 처음 기술되었으며 프랑스 화학자 인 Louis Jacques Thénard (1777-1826)의 이름을 따서 지명되었다..

오스트리아 봄의 물, 황산 나트륨의 십수화물 (나중에 망초로 알려진) 1625 년에 발견 독일어 / 네덜란드 화학자 및 약제사 루돌프 요한 글라 우버 (1604-1670). 그는 약용 성질 때문에 그것을 미라 빌리스 소금 (신기한 소금)이라고 불렀다..
1650 년에서 1660 년 사이, Glauber는 일반적인 소금 (NaCl)과 진한 황산으로부터 황산 나트륨을 제조하기 시작했습니다. 이 과정은 화학 산업의 시작으로 간주됩니다..
그 결정은 20 세기까지 완하제로 사용되었습니다..
18 세기에 Glauber 소금과 칼륨 (탄산 칼륨)의 반응은 소다회 (탄산나트륨)의 산업 생산에 사용되기 시작했으며,.

현재 주로 세제 제조 및 종이 펄프 생산을위한 크라프트 공정 (종이 제조시 주요 방법)에 사용됩니다..
황산 나트륨 광상은 미국, 캐나다, 스페인, 이탈리아, 터키, 루마니아, 멕시코, 보츠와나, 중국, 이집트, 몽골 및 남아프리카 공화국에서 발견됩니다..
주요 생산국은 중국 (강소성과 사천 성)이며, 스페인은 세계에서 가장 큰 글라 우베이트 매장지 (Bereos Cerezo de Río Tirón)가 있으며,.
천연 황산염의 전세계 생산량은 약 800 만 톤으로 추산되며, 다른 산업 공정의 부산물로서 2 ~ 4 백톤.
스페인, 국립 자원 재고 목록 황산 다른 업데이트 데이터 "보유"로 표시 (730) (MT)의 순서 황산나트륨 미네랄 주식에 관한 정보에 따라 추정하고, 300 금강산 "는 다른 자원"으로 분류.
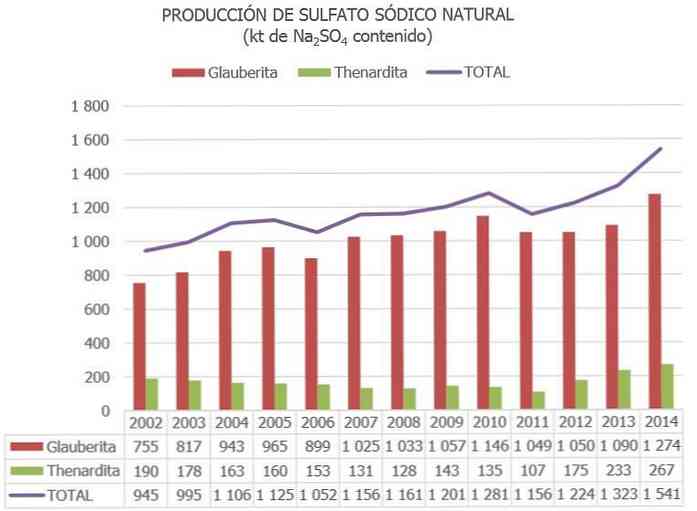
유럽 연합에서 스페인은 현재 황산염 광석 (주로와 타르 테이트 (Butardite), 글 라우 베리 (Glauberite) 및 미라 빌 라이트 (Mirabilite).
현재 섬유 부문의 황산염 수요는 전반적으로 감소하고 있습니다.
최근 몇 년 동안, 세제와 같은 다른 분야는 원자재로 저렴한 가격으로 인해 특정 지역에서 약간의 성장을 경험했습니다.
주요 황산염 세제 시장은 아시아, 중미 및 남미 지역에서 발견됩니다.
수식

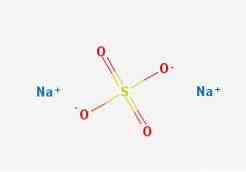
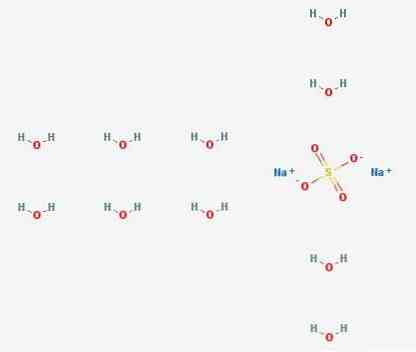
2D 구조
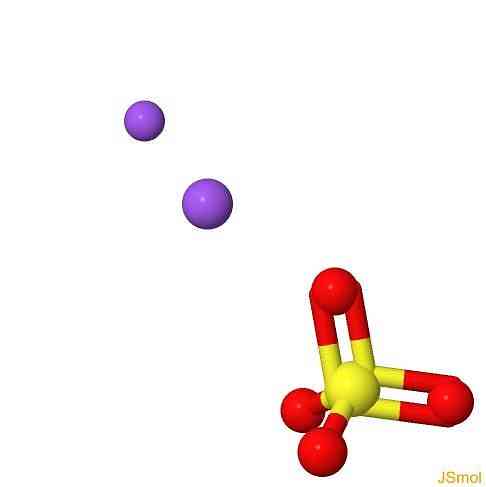
3D 구조
특징
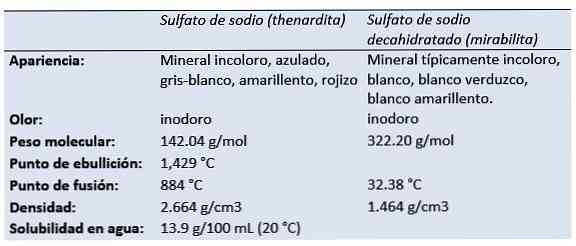
물리 화학적 특성
황산나트륨은 나트륨 화합물의 반응성 그룹에 속하며 황산염, 황산화물 및 이황화 물의 그룹에도 속한다..
인화성
불연성 물질입니다. 파우더 폭발의 위험성이 없습니다..
반응성
황산나트륨은 물에 잘 녹고 흡습성이있다. 그것은 매우 안정적이며 상온에서 대부분의 산화제 또는 환원제에 대해 반응성이 없습니다. 고온에서, 카보네이트 환원에 의해 황화 나트륨으로 전환 될 수있다..
화학적으로 비 반응성 인 물질은 일반적인 환경 조건에서 비 반응성 인 것으로 간주됩니다 (비교적 극단적 인 환경이나 촉매 작용에서 반응 할 수도 있음). 그들은 산화와 환원에 강합니다 (극단적 인 조건을 제외하고).
위험한 화학 반응
알루미늄을 황산나트륨 또는 황산 칼륨과 함께 녹이면 격렬한 폭발이 일어난다..
독성
화학적으로 반응하지 않는 물질은 독성이없는 것으로 간주되지만 (이 그룹의 가스 성 물질은 질식 물질로 작용할 수 있음).
황산나트륨은 일반적으로 무독성으로 간주되지만, 조심스럽게 다루어야합니다. 분말은 천식이나 일시적인 눈 자극을 일으킬 수 있습니다. 눈 보호대와 종이 마스크를 착용하면 이러한 위험을 피할 수 있습니다..
용도
주요 응용 분야는 다음과 같습니다 :
- 세제 분말.
- 종이 펄프.
- 직물.
- 유리.
- 효소의 합성 (와인 제조).
- 인간과 동물의 음식.
- 약국 제품.
- 기초 화학 전반.
- 강철 공정.
- 세제 분말
황산나트륨은 매우 값싼 재료입니다. 그것의 가장 큰 사용은 가루 세제의 필러로서, 약 섭취량입니다. 세계 생산의 50 %. 새로운 소형 또는 액체 세제는 황산나트륨을 포함하지 않으므로이 사용량은 감소하고 있습니다.
특히 미국에서 중요성이 감소하고있는 황산나트륨의 또 다른 용도. 및 캐나다는 목재 펄프 제조용 Kraft 공정에 있습니다. 공정의 열효율이 향상되어 황산나트륨의 필요성이 크게 줄어 들었습니다..
유리 산업은 황산나트륨에 또 다른 중요한 응용 분야를 제공합니다. 유럽에서 두 번째로 큰 응용 프로그램입니다. 황산나트륨은 용융 유리에서 작은 기포를 제거하는 데 사용됩니다..
일본에서는 황산 나트륨의 가장 큰 용도가 직물 제조에 있습니다. 황산나트륨은 염료가 섬유에 균일하게 침투하도록 도와 주며 염색에 사용되는 스테인리스 스틸 용기를 부식시키지 않습니다 (염화나트륨과는 달리 대체 방법 임).
황산나트륨은 32 ° C에서 주어진 고체에서 액체로의 상 변화 동안 높은 축열 용량으로 인해 낮은 열 태양열을 저장하는데 특히 적합합니다 (가열 응용에서 나중에 방출하기 위해)..
냉각 용도의 경우, 염화나트륨 (NaCl)의 일반적인 염과의 혼합물은 융점을 18 ℃로 낮 춥니 다.
실험실에서 무수 황산나트륨은 불활성 건조제로 널리 사용되어 유기 용액에서 미량의 물을 제거합니다. 그 작용은 황산 마그네슘의 작용보다 느리지 만, 화학적으로 상당히 불활성이기 때문에 다양한 물질과 함께 사용할 수 있습니다.
나트륨 황산 10 수화물 (Glauber의 소금)은 역사적으로 완하제로 사용되었습니다. 과다 복용 후 아세트 아미노펜 (아세트 아미노펜)과 같은 특정 약물을 신체에서 제거하는 데 효과적입니다.
황산나트륨의 다른 용도로는 카펫 공기 청정제의 제조에 첨가제로서, 가축 사료에 첨가제로, 전분 제조에 첨가제로서의 용도가있다.
임상 효과
그것의 치료 신청을 위해, 나트륨 황산염은 변비의 처리에서 사용 된 염분 및 cathartic 완하제의 종류에 속한다.
염분 카타 닉은 흡수되지 않은 소금의 삼투 작용에 의해 장내에서 체액을 유지하여 간헐적으로 간헐적으로 증가하는 염입니다.
염분 카타 닉은 위장관에 잘 흡수되지 않으므로 대량의 양을 섭취하지 않으면 전신 독성이 발생하지 않습니다. 그러나, 큰 노출은 화합물의 삼투 효과에 이어 탈수 및 전해질 변화를 일으킬 수있다.
만성 완하제 사용은 섭식 장애, 뭉너 우젠 증후군 또는 동반 된 장애가있는 환자에서 발생할 수 있습니다. 일반적으로 환자들은 복부 경련과 관련된 메스꺼움, 구토 및 설사를 경험합니다. 심한 영향에는 탈수, 저혈압, 고 나트륨 혈증 및 전해질 이상이 포함될 수 있습니다..
보안 및 위험
화학 물질의 분류 및 표시를위한 국제 조화 시스템 (SGA)의 위해 성명.
화학 물질 분류 및 (GHS)의 표지의 세계 조화 시스템은 전 세계적으로 (국가를 일관성있는 기준을 사용하여 다른 나라에서 사용되는 다양한 분류 기준 및 표시를 대체하도록 설계 유엔에 의해 생성 된 국제적으로 합의 된 시스템입니다 2015 년 유나이티드).
(; 유엔, 2015; 유럽 화학 물질 청, 2017 PubChem, 2017)는 다음과 같이 위험 클래스 (및 GHS의 그것의 해당 장) 분류 기준 및 표시 및 황산 나트륨에 대한 권장 사항은 다음과 같습니다 :
GHS의 유해성 등급
H315 : 피부 자극을 일으킴 [경고 피부 부식성 / 자극성 - 구분 2].
H317 : 알레르기 성 피부 반응을 일으킬 수 있음 [경고 민감성, 피부 - 구분 1].
H319 : 눈에 심한 자극을 일으킴 [경고 심각한 눈 마비 / 눈 자극성 - 2Aa].
H412 : 장기적인 부작용이있는 수생 생물에 유해 함 [수생 환경에 유해, 장기 위해 - Category 3].
(PubChem, 2017)
건전한 협의회의 규정
P261, P264, P272, P273, P280, P302 + P352, P351 + P338 + P305, P321, P332 + P313, P333 + P313, P337 + P313, P362, P363, P501 및.
참고 문헌
- ChemIDplus (2017) 7757-82-6의 3D 구조 - 무수 황산 나트륨 [이미지]. 원본 주소 찾기 : chem.nlm.nih.gov.
- ChemIDplus (2017) 7727-73-3의 3D 구조 - 황산나트륨 [USP] [image]. 원본 주소 찾기 : chem.nlm.nih.gov.
- Dyet, D. (2007) 네다다 소다 빌 미네랄 카운티 부근의 네 루다이트 나트륨 황산염 [image] 원본 주소 'en.wikipedia.org'.
- 유럽 화학 물질 청 (ECHA), (2017). 분류 및 표시 요약. 조화 된 분류 - Regulation (EC) No 1272/2008 (CLP Regulation)의 Annex VI. 황산나트륨.
- Grumetisho (2012) Mirabilita [image] 원본 : es.wikipedia.org.
- 유해 물질 데이터 은행 (HSDB). TOXNET (2017). 황산나트륨 Bethesda, MD, EU : 국립 의학 도서관. 원본 주소 'toxnet.nlm.nih.gov'.
- 지질학 및 채광 연구소 (IGME) (2016). GLAUBERITA-THENARDITA (자연 소 황산염) 2014. 광업 파노라마. 검색 원본 : igme.es.
- 국립 직장 안전 연구소 (INSHT). (2010). 국제 안전 화학 기록. 황산나트륨. 고용 안전부. 마드리드 ES 원본 주소 'insht.es'.
- Langbein Rise (2008) 연속 크래프트 펄프 밀 [이미지] 원본 : wikimedia.org.
- 유엔 (2015). 화학 제품의 분류 및 표시를위한 국제 조화 시스템 (SGA) 제 6 개정판. New York, United States : United Nations 간행물. 원본 주소.
- 생명 공학 정보 센터. PubChem 화합물 데이터베이스 (2016) 황산나트륨 - PubChem 구조 [이미지] 베데스다, MD, 유럽 : 국립 의학 도서관. 원본 주소 'pubchem.ncbi.nlm.nih.gov'.
- 생명 공학 정보 센터. PubChem 화합물 데이터베이스 (2016) 황산나트륨 - PubChem 구조 [이미지] 베데스다, MD, 유럽 : 국립 의학 도서관.
- 생명 공학 정보 센터. PubChem 복합 데이터베이스. (2017). 황산 나트륨 10 수화물. Bethesda, MD, EU : 국립 의학 도서관. 원본 주소 'pubchem.ncbi.nlm.nih.gov'.
- 생명 공학 정보 센터. PubChem 복합 데이터베이스. (2017). 황산나트륨 Bethesda, MD, EU : 국립 의학 도서관. 원본 주소 'pubchem.ncbi.nlm.nih.gov'.
- Walkerma (2005) 황산나트륨 [image] 원본 : wikimedia.org.
- Wikipedia (2017) 크래프트 과정. 원본 주소 'wikipedia.org'.
- Wikipedia (2017) Mirabilita. 원본 주소 'wikipedia.org'.
- 위키 백과 (2017) Mirabilite. 원본 주소 'wikipedia.org'.
- 위키피디아 (2017) 황산나트륨. 원본 주소 'wikipedia.org'.
- 위키 백과 (2017) Solfato 디 나트륨 decaidrate. 원본 주소 'https://it.wikipedia.org'.
- 위키피디아 (2017) 황산나트륨. 원본 주소 'wikipedia.org'.
- Wikipedia (2017) Thenardita. 원본 주소 'wikipedia.org'.
- Wikipedia (2017) Thenardite. 원본 주소 : .wikipedia.org.


