유기 소금 물리적 및 화학적 특성, 용도 및 예
그 유기 염 그들은 무수한 특성을 가진 이온 성 화합물의 조밀 한 수이다. 그것들은 이전에 그것이 전하 운반체가 될 수있는 변형을 겪은 유기 화합물로부터 도출되며, 또한 그 화학적 동일성은 결합 된 이온에 의존한다.
아래 이미지에는 유기 염에 대한 두 가지 매우 일반적인 화학식이 나와 있습니다. 첫 번째 물질 인 R-AX는 탄소 구조에서 원자 또는 A 군이 양전하 + 또는 음전 (-)을 갖는 화합물로 해석됩니다..
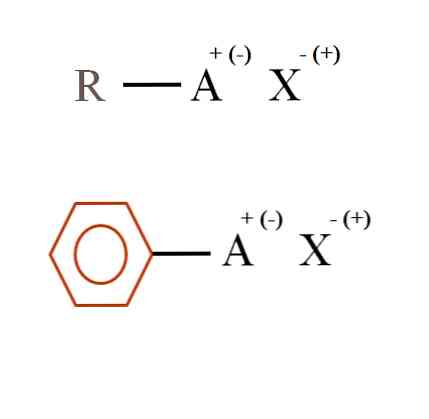
도시 된 바와 같이, R과 A, R-A 간의 공유 결합이 존재하지만, 결과적으로, A는의 특성 및 화학적 환경에 대한 전하의 부호가 달려 이온 X. 유치 (또는 반발) 형식 전하를 갖는다.
A가 양수인 경우 몇 개의 X가 상호 작용할 수 있습니까? 전자 중립성 (+ 1-1 = 0)의 원리가 주어진 단 한 명만 가지고 그러나 X의 정체성은 무엇입니까? 음이온 X는 CO32-, 2 개의 양이온 RA를 필요로 함.+; 할로겐화물 : F-, Cl-, Br-, 등. 또는 심지어 다른 RA 화합물-. 옵션은 헤아릴 수 없다..
또한, 유기 염은 방향족 특성을 가질 수 있는데, 이는 갈색 벤젠 고리로 예시된다. 구리 벤조 에이트 염 (II), (C6H5COO)2예를 들어, Cu는 음이온 성 카르복실기를 갖는 두 개의 방향족 고리로 이루어져 있으며, 이는 양이온과 상호 작용합니다.2+.
색인
- 1 물리 화학적 특성
- 1.1 고 분자량
- 1.2 양친 매성 및 계면 활성제
- 1.3 고비 점 또는 융점
- 1.4 산도 및 염기도
- 2 용도
- 3 유기 염의 예
- 3.1 카르 복실 레이트
- 3.2 리튬 디 아크릴 레이트
- 3.3 설 포늄 염
- 3.4 옥소 늄 염
- 3.5 아민 염
- 3.6 디아 조늄 염
- 4 참고
물리 화학적 특성
이미지로부터 유기 염은 3 가지 성분, 즉 유기 R 또는 Ar (방향족 고리), 이온 성 전하 A를 운반하는 원자 또는 기, 및 반대 이온 X.
그러한 화학적 정체성과 구조가 그러한 구성 요소에 의해 정의되는 것과 마찬가지로, 그것들의 특성은 그들에 의존한다..
이 사실로부터 이들 대부분의 염분을 충족시키는 특정 일반 특성이 요약 될 수 있습니다.
고 분자량
단일 또는 다가 무기 X 음이온을 가정 할 때, 유기 염은 일반적으로 무기 염보다 훨씬 더 큰 분자 질량을 갖는다. 이것은 주로 단순한 C-C 결합과 수소 원자가 화합물에 많은 기여하는 탄소 골격에 기인합니다.
따라서, 이들은 고 분자량을 담당하는 R 또는 Ar입니다.
양친 매성 및 계면 활성제
유기 염은 양친 매성 화합물이다. 즉, 그들의 구조는 친수성과 소수성을 모두 가지고있다..
그런 극단은 무엇입니까? R 또는 Ar은 C 및 H 원자가 물 분자에 대해 큰 친 화성을 갖지 않기 때문에 소수성 말단을 나타낸다..
A+(-), 전하를 운반하는 원자 또는 그룹은 쌍극자 모멘트에 기여하고 물을 형성하는 쌍극자와 상호 작용하기 때문에 친수성 말단이다 (RA+ OH2).
친수성 및 소수성 영역들은 극성 인 경우, 양친 매성 염 널리 세제의 제조에 사용되는 계면 활성제, 물질되고 해 해독제.
고비 점 또는 융점
무기 염으로서, 유기 염 인해 액체 또는 고체상 지배 정전기력 높은 융점과 비점이.
그러나, 유기 성분 R 또는 아르곤을 갖는 정전기로 특정 방식으로 다른 경쟁 판데르 발스 힘의 종류 (런던 힘, 쌍극자 - 쌍극자, 수소 결합)을 포함.
이러한 이유로, 유기 염의 고체 또는 액체 구조는보다 복잡하고 다양합니다. 그들 중 일부는 액정.
산성도 및 염기도
유기 염은 일반적으로 무기 염보다 강한 산 또는 염기입니다. 이는 예를 들어 아민 염에서 A가 추가 수소와의 결합으로 인해 양전하를 띠기 때문입니다. A+-H. 그 다음 기지와 접촉하여 양성자를 기증하여 중립적 인 화합물이 되십시오.
RA+H + B => RA + HB
H는 A에 속하지만 중화 반응에 개입하면서 쓰여진다..
한편, RA+ 그것은 큰 분자 일 수 있고, 히드 록실 음이온 또는 히드 록실 OH로 충분히 안정한 결정질 망상 구조를 갖는 고체를 형성 할 수 없다-.
이 경우 소금 RA+OH- 그것은 강한 기반처럼 행동합니다. NaOH 또는 KOH처럼 염기성도 있음 :
RA+OH- + HCl => RAC1 + H2O
화학 반응식에서 Cl 음이온- 그것은 OH를 대체합니다.-, 소금을 형성 RA+Cl-.
용도
유기 염의 사용은 또한 R, 아르곤, A 및 X의 신원에 따라 달라질 그들은 또한 예정된 애플리케이션은 고체 또는 액체 성형의 종류에 따라 달라진다. 이와 관련하여 다음과 같은 몇 가지 일반 사항이 있습니다.
-이들은 다른 유기 화합물의 합성을위한 시약 역할을합니다. RAX는 R 체인의 "기증자"역할을하여 좋은 퇴출 그룹을 대체하는 다른 화합물에 첨가 될 수 있습니다.
-이들은 계면 활성제이기 때문에 윤활제로도 사용할 수 있습니다. 이 목적으로 카르 복실 레이트의 금속염이 사용됩니다.
-그들은 다양한 염료를 합성 할 수 있습니다..
유기 염의 예
카르 복실 레이트
카르 복실 산은 중화 반응에서 수산화물과 반응하여 카르 복실 레이트의 염을 생성한다 : RCOO- 남+; 여기서 M+ 금속 양이온 (Na+, Pb2+, 케이+, 등) 또는 NH 암모늄 양이온4+.
지방산은 장쇄 지방족 카르복시산이며 포화되거나 불포화 될 수 있습니다. 팔 미트 산 (CH)은 포화 상태3(CH2)14COOH). 이것은 팔미틴산 염 (palmitate salt)을 유발하는 반면, 스테아르 산 (stearic acid, CH3(CH2)16COOH는 스테아린산 염을 형성합니다. 비누는이 소금들로 이루어져 있습니다..
벤조산의 경우, C6H5COOH (여기서 C6H5- 그것은 벤젠 고리이다), 염기와 반응 할 때 벤조산 염을 형성한다. 모든 카르 복실 산염에서, -COO 기- A (RAX).
리튬 diacupuprates
리튬 diacuprate는 유기 합성에 유용합니다. 그 공식은 [R-Cu-R]-리+, 구리 원자는 음전하를 띠고있다. 여기서, 구리는 이미지의 원자 A를 나타낸다..
설 포늄 염
이들은 유기 황화물과 알킬 할로겐화물의 반응으로부터 형성된다 :
R2S + R'X => R2R+X
이들 염에있어서, 황 원자는 양의 공식 전하를 띠며 (S+) 3 개의 공유 결합.
옥소 늄염
또한, 에테르 (황화물의 산화 된 유사체)는 하이드 록 사이드와 반응하여 옥소 늄염을 형성한다 :
ROR '+ HBr <=> 소유주+HR '+ Br-
HBr의 산성 양성자는 에테르의 산소 원자에 공유 결합되어있다 (R2O+-H), 적극적으로로드.
아민 염
아민은 1 차, 2 차, 3 차 또는 4 차뿐만 아니라 이들의 염일 수있다. 이들 모두는 H 원자가 질소 원자와 연결되어있는 것을 특징으로한다.
그래서, RNH3+X- 그것은 1 급 아민 염이다; R2NH2+X-, 의 2 급 아민; R3NH+X-, 의 3 차 아민; 및 R4N+X-, 4 급 아민 (4 급 암모늄염).
디아 조늄 염
마지막으로, 디아 조 늄염 (RN2+X-) 또는 아르 딜 디아 늄 (Arild)2+X-)는 많은 유기 화합물, 특히 아조 염료의 출발점을 나타냅니다.
참고 문헌
- Francis A. Carey. 유기 화학 (Sixth Edition., P604-605, 697-698, 924). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. 유기 화학. 아민 (제 10 판). 와일리 플러스.
- 위키 백과. (2018). 소금 (화학). 출처 : en.wikipedia.org
- Steven A. Hardinger. (2017). 유기 화학 용어 설명 : 염. 원본 주소 'chem.ucla.edu'
- 셰브론 오로 나이트. (2011). 카르 복실 레이트. [PDF] 원본 주소 : oronite.com


