Picric acid 구조, 합성, 특성 및 용도
그 피크닉 애씨드 IUPAC의 이름이 2,4,6-trinitrophenol 인 고도로 질산화 된 유기 화합물입니다. 그 분자식은 C6H2(NO2)3오하이오. 그것은 매우 산성 페놀이며 나트륨, 암모늄 또는 칼륨 picrate로 찾을 수 있습니다; 즉, 그것의 이온 형태 C6H2(NO2)3ONA.
그것은 쓴 맛이 강한 단단한 것이며, 거기에서 그 이름을 그리스어 'prikos'라는 단어에서 파생합니다.이 단어는 쓰라린 의미입니다. 그것은 젖은 노란색 결정으로 발견된다. 그것의 건조 또는 탈수는 폭발적으로되는 불안정한 성질을 증가시키기 때문에 위험합니다..
위 그림은 picric acid 분자입니다. 이미지에서 반 데르 발스 표면의 표현에 해당하기 때문에 결합과 원자를 인식하기가 어렵습니다. 분자 구조는 다음 절에서 더 자세히 논의된다..
일부 중간 화합물, 다양한 picrate 소금 및 picric 산 복합체는 picric acid에서 합성됩니다..
Picric acid는 황색 영구 염료의 합성을위한 기초로 사용됩니다. 일부 병리학 자들과 연구자들은 그것을 조직 절편의 고정 또는 염색 및 기타 면역 조직 화학적 과정에서 사용합니다.
이것은 의약품 제조에 매우 유용합니다. 또한 성냥이나 성냥 및 폭발물 제조에 사용됩니다. 또한 금속 조각, 유색 유리의 제조, 크레아티닌과 같은 생물학적 변수의 비색식 결정에 사용됩니다.
반면에 picric acid는 호흡기, 안구 및 소화 점막과 피부 접촉시 자극적입니다. 피부를 손상시키는 것 외에도 신장, 혈액 및 간, 다른 기관에 심각한 영향을 미칠 수 있습니다.
색인
- 1 구조
- 1.1 산성 페놀
- 1.2 결정 구조
- 2 요약
- 2.1 페놀의 직접적인 니트 레이션
- 3 물리 화학적 특성
- 3.1 분자량
- 3.2 외관
- 3.3 냄새
- 3.4 맛
- 3.5 융점
- 3.6 끓는점
- 3.7 밀도
- 3.8 용해도
- 3.9 부식
- 3.10 pKa
- 3.11 불안정성
- 4 용도
- 4.1 연구
- 4.2 유기 화학
- 4.3 업계에서
- 4.4 군사 응용 프로그램
- 5 독성
- 6 참고 문헌
구조

위 이미지에서, picric acid 분자의 모든 연결과 구조 자체가 더 자세하게 표시됩니다. 그것은 3 개의 니트로 치환기를 가진 페놀로 이루어져있다..
NO 그룹에서2 질소 원자는 양의 부분 전하를 가지며, 따라서 그 주변의 전자 밀도에 대한 요구가있다. 그러나, 방향족 고리는 전자 자체를 끌어 당기고, 3 개의 NO2 그것은 자신의 전자 밀도의 일부를 포기하게된다..
이 결과로, OH 그룹의 산소는 반지에 의해 고통받는 전자 부족을 공급하기 위해 더 많은 자유 전자쌍 중 하나를 공유하는 경향이있다. 그렇게함으로써, C = O 링크가 형성된다+-산소에 대한 부분적 부분 하중은 O-H 결합을 약화시키고 산도를 증가시킨다. 즉, 그것은 수소 이온, H+.
산성 페놀
이러한 이유 때문에이 화합물은 아세트산 그 자체보다 훨씬 강력하고 반응성이 강한 산입니다. 그러나이 화합물은 실제로 다른 페놀의 산도를 능가하는 페놀입니다. 방금 언급 한 바와 같이 NO 치환체로 인해2.
그러므로 페놀 (phenol)이므로 OH 기가 우선 순위를 가지며 구조에 열거를 지시합니다. 3 개의 NO2 그들은 OH에 대하여 방향족 고리의 탄소 2, 4 및 6에 위치한다. 따라서이 화합물에 대한 IUPAC 명명법 : 2,4,6-Trinitrophenol (TNP, 영어 약어).
그룹이 아닌 경우2, 또는 고리 내에 더 적은 수가 있으면 O-H 결합이 약화되어 화합물의 산도가 낮아집니다.
결정 구조
picric acid의 분자는 분자간 상호 작용을 돕는 방식으로 배열되어있다. OH와 NO 기 사이의 수소 브릿지 형성2, 쌍극자 - 쌍극자 힘, 또는 전자의 결핍 된 부분 사이의 정전 기적 반발력.
그룹이하지 않을 것으로 예상 될 수 있습니다.2 그들은 서로 쫓아 냄으로서 이웃하는 방향족 고리쪽으로 향하게 될 것이다. 또한, 정전 기적 반발의 증가에 의해 서로의 상부에 링을 정렬 할 수 없다.
이러한 모든 상호 작용의 산물 인 picric acid는 결정을 정의하는 3 차원 네트워크를 형성합니다. 그 단위 셀은 사방 정계 (orthorhombic) 형의 결정계에 해당한다..
합성
처음에는 동물 호른 유도체, 천연 수지 등과 같은 천연 화합물로부터 합성되었습니다. 1841 년 이래로 페놀은 몇 가지 경로 또는 다양한 화학적 절차를 거쳐 피크 리크 산의 전구체로 사용되어왔다.
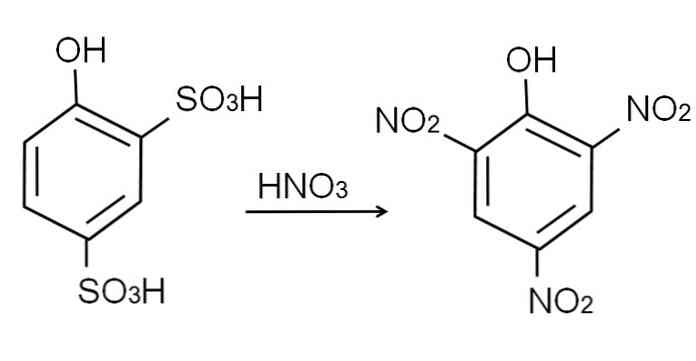
이미 말했듯이, 그것은 가장 산성 인 페놀 중 하나입니다. 이를 합성하기 위해서는, 먼저 페놀이 술 폰화 공정을 거쳐야하고, 그 다음에 니트로 화 절차.
무수 페놀의 설 폰화는 페놀을 발연 황산으로 처리하고, H의 술포 네이트 그룹에 의한 방향족 친 전자 성 치환, SO3H는 -OR 위치에 있고 -OH 그룹에 대해서는.
이 생성물, 2,4-fenoldisulfonic acid에 니트로 화 공정을 수행하여 농축 질산으로 처리한다. 그렇게하는 과정에서 두 SO 그룹3H는 니트로기로 치환되고, NO2, 세 번째는 다른 니트로 위치에 진입합니다. 다음의 화학 반응식은이를 설명합니다 :
페놀의 직접 질산
고 분자량의 타르가 생성되기 때문에 페놀의 질화 공정을 직접 수행 할 수 없습니다. 이 합성 방법은 매우 발열 성이므로 온도를 매우 조심스럽게 조절해야합니다.
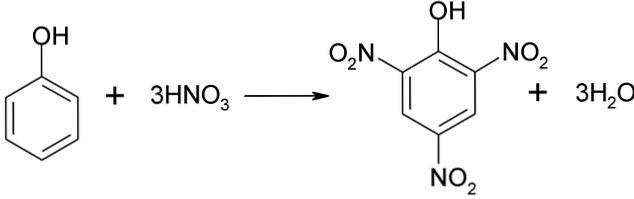
Picric acid는 2,4- 디 니트로 페놀과 질산과의 직접 니트로 화 공정.
또 다른 형태의 합성은 벤젠을 질산 및 수은 질산염으로 처리하는 것이다.
물리 화학적 특성
분자량
229.104 g / mol.
외관
젖은 결정의 질량 또는 황색 현탁액.
냄새
그것은 무취이다..
맛
매우 씁쓸하다..
융점
122.5 ° C.
끓는점
300 ℃ 그러나 녹을 때 폭발합니다..
밀도
1.77 g / mL.
용해도
그것은 물에 알맞게 용해되는 화합물입니다. 이것은 그들의 OH 그룹과 NO 그룹2 수소 결합을 통해 물 분자와 상호 작용할 수있다. 방향족 고리는 소수성이기 때문에 그 용해도가 손상된다.
부식
Picric acid는 주석 및 알루미늄을 제외하고 일반적으로 금속에 부식성이있다..
pKa
0.38이다. 그것은 강한 유기산.
불안정성
피크 리크 산은 불안정한 특성을 특징으로합니다. 환경에 위험을 초래하며, 불안정하고 폭발성이며 독성이 있습니다..
그것은 picric acid가 건조되도록 허용되면 매우 폭발하기 때문에 탈수를 피하기 위해 밀폐하여 보관해야합니다. 그것이 마찰, 충격 및 열에 매우 민감하기 때문에 하나는 무수 형태에 매우주의해야합니다..
Picric acid는 산화 가능한 물질이없는 환기되고 시원한 장소에 보관해야합니다. 그것은 피부 및 점막에 자극적이며, 삼켜서는 안되며 신체에 유독합니다.
용도
Picric acid는 연구, 화학, 산업 및 군대에서 널리 사용되었습니다..
조사
세포와 조직의 고정액으로 사용될 때 산성 염료로 이들의 착색 결과를 향상시킵니다. 그것은 삼색 착색 방법으로 발생합니다. 포르말린으로 조직을 고정시킨 후, picric acid로 새로운 고정을 권장합니다.
이 방법으로 조직의 강렬하고 매우 밝은 색상이 보장됩니다. 기본 염료에서는 좋은 결과를 얻을 수 없습니다. 그러나 시간이 너무 오래 걸리면 picric acid가 DNA를 가수 분해 할 수 있으므로 예방 조치를 취해야합니다..
유기 화학
-유기 화학에서는 알칼리성 피크크 레이트로 사용되어 다양한 물질의 확인 및 분석을 수행합니다.
-그것은 금속의 분석 화학에 사용됩니다..
-임상 실험실에서는 혈청 및 요중 크레아티닌 농도 측정에 사용됩니다.
-그것은 또한 포도당 수준의 분석에 사용되는 시약의 일부에서 사용되었습니다.
업계에서
-사진 업계 수준에서 picric acid는 사진 유제의 감광제로 사용되었습니다. 살충제, 강력한 살충제와 같은 제품 개발의 일부가되었습니다..
-Picric acid는 예를 들어 chloropicrin과 picramic acid와 같은 다른 중간 화합물을 합성하는 데 사용됩니다. 가죽 산업을위한 일부 약물 및 염료가 이들 화합물로부터 개발되었습니다.
-Picric acid는 독성이 입증되기 전에 소독제 및 기타 조건으로 화상 치료에 사용되기 시작했습니다..
-성냥 및 건전지 제조의 폭발적인 성격 때문에 중요한 구성 요소.
군용 애플리케이션
-picric acid의 폭발성이 높아 군사용 탄약 공장에서 사용되었습니다.
-압축되고 녹은 picric acid는 포탄, 수류탄, 폭탄 및 광산에서 사용되었습니다..
-picric acid의 암모늄염은 폭발물로 사용되었지만 TNT보다 강력하지만 불안정합니다. 한동안 그것은 로켓 연료의 구성 요소로 사용되었습니다..
독성
인체와 일반적으로 모든 생명체에게 매우 유독 함이 입증되었습니다..
급성 경구 독성으로 인해 흡입 및 섭취를 피할 것을 권장합니다. 그것은 또한 미생물에서 돌연변이를 유발합니다. 야생 동물, 포유류 및 일반적으로 환경에 대한 독성 영향을 나타냅니다..
참고 문헌
- Graham Solomons T.W., Craig B. Fryhle. (2011). 유기 화학. 아민 (10일 판.). 와일리 플러스.
- Carey F. (2008). 유기 화학 (여섯 번째 판). Mc Graw Hill.
- 위키 백과. (2018). Picric acid. 원본 주소 'en.wikipedia.org'
- 퍼듀 대학교. (2004). Picric acid 폭발. 원본 주소 'chemed.chem.purdue.edu'
- 결정학 365 프로젝트. (2014 년 2 월 10 일). 부드러운 노란색보다 적습니다 - 피크닉 산의 구조. 원본 주소 'crystallography365.wordpress.com'
- PubChem. (2019). 픽 크릭 애씨드 원본 주소 'pubchem.ncbi.nlm.nih.gov'
- Baker, J. R. (1958). 픽 크릭 애씨드 Methuen, 런던, 영국.


