Ziehl-Neelsen Stain 기초, 시약 및 기술
그 Ziehl-Neelsen 얼룩 알코올 내성 미생물 (AAR)을 확인하기위한 착색 기술. 이 미생물학 과정의 이름은 그 저자들 : 세균 학자 Franz Ziehl과 병리학자인 Friedrich Neelsen.
이 기법은 차동 착색의 한 유형으로, 관찰하고 차별화하고 나중에 식별하려는 구조간에 대비를 만들기 위해 서로 다른 염료를 사용하는 것을 의미합니다. Ziehl-Neelsen 염색법은 특정 유형의 미생물을 확인하는 데 사용됩니다.
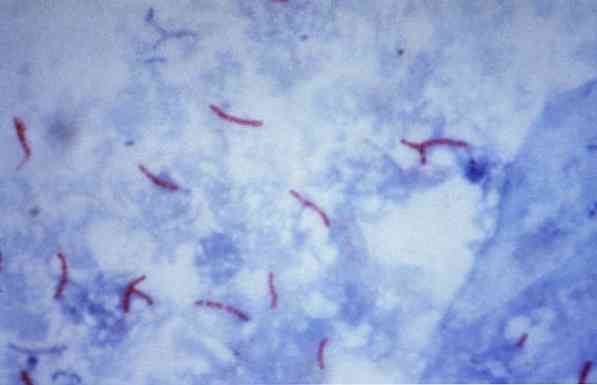
이러한 미생물 중 일부는 마이코 박테리아 (예 :, Mycobacterium tuberculosis), 심 부정 (예 :, 노카 디아 sp.) 및 일부 단세포 기생충 (예 :, 크립토 스포 리듐 파르 밤). 많은 박테리아는 그람 염색이라는 일반적인 기술을 통해 분류 될 수 있습니다..
그러나 일부 세균 군에서는이를 확인하기 위해 다른 방법이 필요합니다. Ziehl-Neelsen 염색과 같은 기술은 염료와 세포벽을 먼저 고착시키기 위해 염료의 조합을 필요로합니다.
그런 다음 두 가지 결과를내는 변색 과정이 발생합니다 : 산과 알콜에 의한 변색에 대한 내성 또는 민감성.
색인
- 1 재단
- 1.1 2 차 착색
- 2 시약
- 2.1 기본 착색제
- 2.2 탈색 용액
- 2.3 2 차 착색 (착색 방지제)
- 3 기술
- 3.1 빠른 산성 염색 절차
- 4 참고
재단
이 염색 기술의 기초는이 미생물의 세포벽 특성에 기초합니다. 벽은 mycolic acid라고 불리는 일종의 지방산으로 형성됩니다. 이들은 매우 긴 체인이 특징입니다.
지방산이 매우 긴 구조를 가지면 염료를 더 쉽게 유지할 수 있습니다. 일부 속균은 그람 염색에 의해 세포벽의 높은 미 콜릭 산 함량으로 인해 염색하기가 매우 어렵습니다.
Ziehl-Neelsen 염색에서 페놀 화합물 인 carbol fuchsin (염기성 염료)이 사용됩니다. 이것은 상온에서 왁스 같은 질감 인 세포벽의 지방산과 상호 작용하는 능력을 가지고 있습니다.
Carbol fuchsin 염색은 왁스가 녹고 염료 분자가 세포벽으로 더 빠르게 이동하기 때문에 열의 존재 하에서 개선됩니다..
나중에 사용 된 산은 벽이 착색제와 충분히 관련이 없으므로 얼룩이지지 않은 세포를 변색시키는 역할을합니다. 따라서, 산 탈색제의 강도는 산성 염료를 제거 할 수있다. 이 변색에 저항하는 세포를 내산성이라고합니다..
2 차 착색
샘플이 변색 된 후에는 이차 염료라는 다른 염료와 대조됩니다. 메틸렌 블루 또는 말라카이트 그린이 일반적으로 사용됩니다.
2 차 염료는 배경 재료를 얼룩지게하고 결과적으로 첫 번째 단계에서 염색 된 구조와 대조를 이룹니다. 내산성 세포는 붉은 색을 유지하면서 변색 된 세포 만이 두 번째 염료 (안티 - 얼룩)를 흡수하고 색을 나타냅니다..
이 절차는 자주 식별을 위해 사용됩니다. Mycobacterium tuberculosis 및 Mycobacterium leprae, 산 - 빠른 바실러스 (acid-fast bacilli)라고 불리는.
시약
1 차 채색
Carboxin 0.3 % fuchsin (여과)가 사용됩니다. 이 염료는 에탄올 (90 %) 또는 메탄올 (95 %) 중의 알콜 : 페놀의 혼합물로부터 제조되며,이 혼합물에서 3g의 염기성 푹신은 용해된다.
탈색 용액
이 단계에서는 3 % 알콜 산 또는 25 % 황산 용액을 사용할 수 있습니다.
2 차 착색 (착색 방지제)
샘플에서 대비를 수행하는 데 가장 일반적으로 사용되는 염료는 보통 0.3 % 메틸렌 블루입니다. 그러나 0.5 % 말라 카이트 그린.
기술
산성 염색 절차
박테리아 번짐을 준비하십시오.
이 준비는 무균주의 사항에 따라 깨끗하고 건조한 슬라이드에서 실시합니다..
스미어 건조
스미어가 실온에서 말리도록하십시오.
샘플 가열
샘플은 아래 슬라이드에 불을 붙여 가열해야합니다. 도말이 객담 (차가운 차아 염소산염으로 치료하여)으로 준비되지 않았거나 즉시 염색되지 않을 경우 알코올로 고정 할 수 있습니다..
마이 코박 테 리움 튜 버쿨 로시스 표백제와 염색 공정 중에 제거됩니다. 치료하지 않은 가래의 열 고정은 죽이지 않습니다. 마이 코박 테 리움 튜 버쿨 로시스, 알콜과의 고정은 살균.
얼룩 덮다.
얼룩은 carbol fuchsin 용액으로 덮여 있습니다 (1 차 염색).
얼룩 가열
이 작업은 5 분 동안 수행됩니다. 증기 방출 (약 60 ° C)에 주목해야합니다. 과열을 피하고 샘플을 태우는 것을 피하는 것이 중요합니다..
얼룩의 가열과 관련하여, 특히 얼룩이 이전의 얼룩으로부터 가연성이 높은 화학 물질이 수집 된 트레이 또는 기타 용기에서 수행되는 경우, 푹신 carbol을 가열 할 때 큰주의를 기울여야합니다.
미리 산 알콜, 메탄올 또는 70 % 에탄올로 몇 방울 적신 조명이 달린 면봉을 사용하여 슬라이드 아래에 작은 불꽃을 뿌려야합니다. 화재 위험이 있으므로 에탄올에 담긴 큰 면봉을 사용하지 마십시오..
얼룩을 닦아 라.
이 세척은 깨끗한 물로해야합니다. 수돗물이 깨끗하지 않으면, 여과 또는 증류수로 도말을 씻어 내고,.
산 알콜로 얼룩을가립니다.
이 산성 알코올은 3 %이어야합니다. 5 분 동안 또는 도말이 충분히 변색 될 때까지 즉 옅은 분홍색으로 덮음.
산성 알코올은 가연성이므로 반드시 고려해야합니다. 따라서 매우 신중하게 사용해야합니다. 거의 점화원이되지 않도록하십시오..
얼룩을 닦아 라.
세척은 깨끗한 증류수로해야합니다..
염료로 얼룩을 가린다.
그것은 얼룩이 얇은 경우 가장 긴 시간을 사용하여 1 분 또는 2 분 동안 녹색 공작석 (0.5 %) 또는 메틸렌 블루 (0.3 %) 염료 일 수 있습니다.
얼룩을 닦아 라.
깨끗한 물은 다시 사용해야합니다 (증류).
배수구
슬라이드 뒷면을 청소하고 배수 선반에 얼룩을 두어 공기 건조되도록하십시오 (건조시 흡수지를 사용하지 마십시오).
현미경으로 얼룩 검사
100X 대물 렌즈와 침지 오일을 사용해야합니다. 체계적으로 스미어를 스캔하고 관련 관측을 적어 둡니다..
결과 해석
이론적으로, 붉은 색으로 염색 된 미생물은 산 - 빠른 양성 (AAR +)으로 간주되며,.
반대로, 미생물이 반대 염료로 사용되는 염료에 따라 청색 또는 녹색으로 염색되면 음이온 내성 산 (AAR-)으로 간주됩니다..
참고 문헌
- Apurba, S. & Sandhya, B. (2016). 실용 미생물학의 기초 (1 판). Jaypee 형제 의학 발행인.
- Bauman, R. (2014). 신체 시스템에 의한 질병 미생물학 (4th ed.). 피어슨 교육, Inc의.
- Heritage, J., Evans, E. & Killington, A. (1996). 입문 미생물학 (1 판). 케임브리지 대학 출판부.
- Morello, J., Granato, P. Wilson, M. & Morton, V. (2006). 실험실 매뉴얼 및 미생물학 워크 북 : 환자 치료에 응용 (11 판). McGraw-Hill 교육.
- Vasanthakumari, R. (2007). 미생물학 교본 (1 판). B.I. 간행물 PVT.


