이중 치환 반응 유형 및 예
그 이중 치환 반응, 이중 치환 또는 복분해는 이중 이온 교환이 이들 화합물의 산화 또는 환원없이 두 화합물 사이에서 일어나는 것이다. 그것은 가장 기본적인 화학 반응 중 하나입니다..
새로운 결합은 이온들 사이의 큰 정전 인력에 의해 형성됩니다. 또한, 반응은 주로 물 분자와 같은보다 안정한 종의 형성을 선호한다. 이중 치환 반응에 대한 일반적인 화학 반응식은 아래 그림에 나와 있습니다.
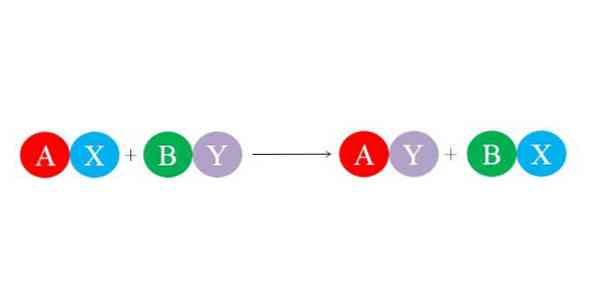
초기 화합물 AX와 BY는 "그들의 파트너"를 교환함으로써 반응하여 두 개의 새로운 화합물 인 AY와 BX를 형성합니다. 이 반응은 A와 Y가 A와 B보다 더 관련이 있거나 BX 링크가 BY보다 안정하면 발생합니다. 반응은 단순한 이온 교환이기 때문에 전자가 손실되거나 전자가 손실되지 않습니다 (산화 환원 반응).
따라서, A가 화합물 AX에서 전하 양이온 +1이면, 이는 화합물 AY에서 동일한 전하 +1을 가질 것이다. "편지"의 나머지 부분도 마찬가지입니다. 이러한 유형의 반응은 산 - 염기 반응과 침전물 형성을지지한다..
색인
- 1 가지 유형
- 1.1 중화
- 1.2 강수
- 2 예
- 2.1 예제 1
- 2.2 예제 2
- 2.3 예제 3
- 2.4 예제 4
- 2.5 예 5
- 2.6 예제 6
- 2.7 예제 7
- 2.8 예 8
- 3 참고
유형
중화
강산은 강한 염기와 반응하여 용해되는 염과 물을 생성합니다. 두 가지 중 하나 인 산 또는 염기가 약할 때 생성 된 염은 완전히 이온화되지 않습니다. 즉 가수 분해 할 수있는 수성 매질에서 수행된다. 마찬가지로, 산 또는 염기는 염으로 중화 될 수있다.
위의 기호는 다시 AXBY라는 문자가 붙은 화학 반응식으로 나타낼 수 있습니다. 그러나, 브 st스 테드 산성도는 H 이온+ 및 OH-, 이들은 문자 A와 Y를 나타냅니다.
HX + BOH => HOH + BX
이 화학 반응식은 중화에 해당하며 HX 산과 BOH 염기가 HOH (H2O) 및 물에 용해 될 수도 용해하지 않을 수도있는 BX 염.
귀하의 골격은 화학 양 론적 계수 또는 산 (유기 또는 무기)의 성질에 따라 달라질 수 있습니다..
강수량
이러한 유형의 반응에서, 생성물 중 하나는 매질에 불용성이며, 일반적으로 수성이며, 침전된다 (고체는 나머지 용액으로부터 응고된다).
그 구조는 다음과 같다 : 두 개의 용해성 화합물, AX와 BY가 혼합되고, 용해도 규칙에 따라 달라지는 AY 또는 BX 생성물 중 하나가 침전한다 :
AX + BY => AY (s) + BX
AX + BY => AY + BX (s)
AY와 BX가 모두 물에 불용 인 경우 가장 강한 정전기 상호 작용을 나타내는 이온 쌍이 침전되어 용해도 상수 값 (Kps)에 정량적으로 반영 될 수 있습니다..
그러나, 대부분의 침전 반응에서, 하나의 염은 용해성이고 다른 것은 침전한다. 두 반응 - 중화 및 침전 - 같은 물질의 혼합물에서 발생할 수 있습니다.
예제들
예제 1
HCl (ac) + NaOH (ac) => H2O (1) + NaCl (ac)
어떤 반응인가요? 염산은 수산화 나트륨과 반응하여 결과적으로 물과 염화나트륨을 생성합니다. NaCl은 수성 매질에 매우 용해되기 때문에 물 분자도 형성되기 때문에, 실시 예 1의 반응은 중화.
예제 2
Cu (NO3)2(ac) + Na2S (ac) => CuS (s) + 2NaNO3(ac)
이 반응에서 H 이온은 존재하지 않는다.+ 도 아니다 OH-, 물 분자는 화학 반응식의 오른쪽에 보이지 않는다..
구리 (II) 질산염 또는 질산 구리는 나트륨 이온과 황화 나트륨을 교환합니다. 구리 황화물은 용해되지 않으며 질산 나트륨과 달리 석출되며 용해성 염.
Cu (NO3)2 그것은 파란색이고, Na2S는 황색을 띤다. 두 가지가 섞이면 색상이 사라지고 CuS가 침전되며 검은 색 고체가됩니다.
예제 3
CH3COOH (ac) + NaOH (ac) => CH3COONa (ac) + H2O (l)
다시 말하지만, 이것은 또 다른 중화 반응입니다. 아세트산은 수산화 나트륨과 반응하여 아세트산 나트륨 염 및 물 분자를 형성한다.
예 1과 달리, 나트륨 아세테이트는 음이온이 가수 분해되기 때문에 완전히 이온화 된 염이 아닙니다.
CH3COO-(ac) + H2O (l) <=> CH3COOH (ac) + OH-(ac)
예제 4
2HI (ac) + CaCO3(s) => H2콜로라도 주3(ac) + Ca2(ac)
중화 작용을 일으키지는 않지만이 산화 반응에서는 석회석과 완전히 반응하여 탄산과 요오드화 칼슘을 생성합니다. 또한, 열 방출 (발열 반응)은 탄산을 이산화탄소와 물로 분해합니다 :
H2콜로라도 주3(ac) => CO2(g) + H2O (l)
세계적인 반응은 다음과 같습니다.
2HI (ac) + CaCO3(s) => CO2(g) + H2O (1) + CaI2(ac)
또한, 탄산 칼슘 염기는 염산.
실시 예 5
AgNO3(ac) + NaCl (ac) => AgCl (s) + NaNO3(ac)
질산은은 염화나트륨과 이온 교환하여 염화은 (백색 침전물)의 불용성 염과 질산 나트륨.
보기 6
2H3PO4(ac) + 3Ca (OH)2(ac) => 6H2O (1) + Ca3(PO4)2(들)
인산은 수산화칼슘에 의해 중화되어 불용성 인산 칼슘 인산염과 6 몰의 물 분자를 형성한다.
이것은 두 유형의 이중 치환 반응의 예이다 : 산의 중화 및 불용성 염의 침전.
보기 7
케이2S (ac) + MgSO4(ac) => K2그래서4(ac) + MgS (s)
황화 칼륨은 황산 마그네슘과 반응하여 용액에서 함께 나오는 S 이온2- 및 Mg2+ 불용성 염화 마그네슘 설파이드 및 가용성 염 칼륨 설페이트를 형성한다.
실시 예 8
Na2S (ac) + HCl (ac) → NaCl (ac) + H2S (g)
황화 나트륨은 염산을 중화시켜 염화 나트륨과 황화수소를 생성합니다..
이 반응에서 (가장 일반적인 중화와는 달리) 물을 형성하지는 않지만 썩은 알의 냄새는 매우 불쾌한 무전 해 황화수소 분자입니다. H2S는 기체 형태로 용해를 피하고 나머지 종들은 용해된다.
참고 문헌
- Whitten, Davis, Peck & Stanley. 화학 (8 판). CENGAGE 학습, 150-155 페이지.
- Quimicas.net (2018). 이중 교체 반응의 예. 2018 년 5 월 28 일 검색, quimicas.net
- 메타 세 시스 반응. 2018 년 5 월 28 일에 검색 한 사람 : science.uwaterloo.ca
- 칸 아카데미. (2018). 이중 치환 반응. 2018 년 5 월 28 일에 가져온 사람 : khanacademy.org
- Helmenstine, Anne Marie, Ph.D. (2016 년 5 월 8 일). 이중 교체 반응 정의. 2018 년 5 월 28 일에 검색 한 사람 : thoughtco.com


