마그네슘 수 소화물 공식, 화학 구조 및 특성
그 마그네슘 수 소화물 (MgH2 분자식의)은 7.66 %의 수소 중량 함량을 갖는 화학적 화합물이며 자연에서 백색 결정질 고체로 발견된다. 주로 수소의 저장 매체로 연구되었지만 다른 화학 물질을 준비하는 데 주로 사용됩니다..
그것은 염분 (또는 이온) 수 소화물의 계열에 속하며, 음이온을 띤 H- 이온으로 정의됩니다. 이 수 소화물은 알칼리 금속 및 알칼리 토금속으로 형성되는 것으로 간주되지만 마그네슘 (및 베릴륨)의 경우 공유 결합을 가지며이 수 소화물의 특성을 나타내는 이오 네이트.
색인
- 1 준비 및 공식
- 2 화학 구조
- 3 물리 화학적 특성
- 3.1 물리적
- 3.2 화학 제품
- 4 용도
- 4.1 수소 저장
- 4.2 수소화 반응과 탈수소 반응
- 4.3 진흙
- 4.4 연료 전지
- 4.5 운송 및 에너지
- 4.6 알킬화
- 5 가지 위험
- 5.1 물과의 반응
- 5.2 자연 발화성
- 6 참고 문헌
준비와 공식
마그네슘 하이드 라이드는 고압 및 고온 (200 기압, 500 ℃)의 조건에서 MgI 촉매를 사용하여 마그네슘 (Mg) 금속을 직접 수소화함으로써 형성된다2. 그 반응은 다음과 같습니다.
Mg + H2→ MgH2
MgH의 생산 또한 연구되었다2 볼밀에서 제조 된 나노 결정 마그네슘을 사용하여보다 낮은 온도에서.
다른 제조 방법도 있으나 더 복잡한 화학 반응 (마그네슘 - 안트라센의 수소화, 디 에틸 마그네슘과 리튬 - 알루미늄 하이드 라이드의 반응, 그리고 MgH 복합체의 생성물로서의 반응2).
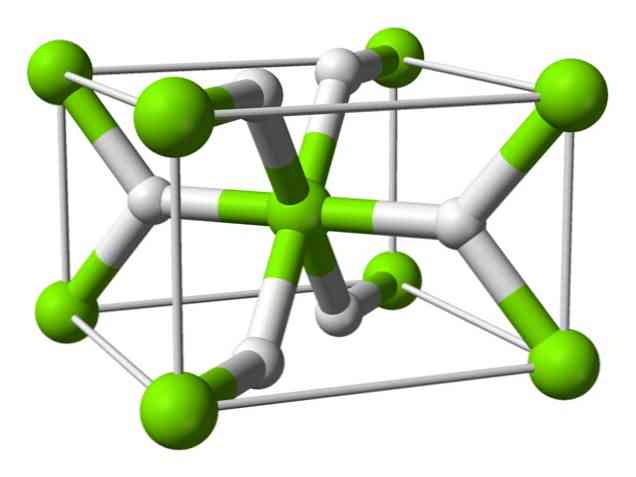
화학 구조
이 원자는 정방 결정 구조를 지닌 실온에서 루틸 (rutile) 구조를 가지고있다. 그것은 고압 조건 하에서 적어도 4 가지 형태를 가지며, 수소 결핍을 가진 비 화학 양 론적 구조가 관찰되었다; 후자는 형성 될 때 매우 적은 양의 입자에서만 발생한다.
위에서 언급했듯이 루틸 구조에 존재하는 결합은 다른 염분 하이드 라이드와 같이 순전히 이온 성이 아니라 부분적으로 공유 결합 성질을 갖는다.
이것은 마그네슘 원자가 완전히 이온화 된 구형을 갖게하지만, 그 하이드 라이드 이온은 긴 구조를 갖는다.
물리 화학적 특성
물리적 인
- 외관 : 백색 결정.
- 몰 질량 : 26.3209 g / 몰
- 밀도 : 1.45 g / cm3
- 녹는 점 : 285 ° C 분해
- 용해도 : 물에서 분해됩니다.
이 화합물은 분자량이 26,321 g / mol이고 밀도가 1.45 g / cm3이고 융점이 327 ° C이다..
화학 제품
- 기타 화학 물질 생산 용 전구체.
- 가능한 에너지 원으로서의 수소 저장.
- 유기 합성에서의 환원제.
이 화합물은 액체 상태로 만들 수 없으며, 운반되거나 융점을 받거나 물에 들어가면 분해됩니다. 이 수 소화물은 에테르에 불용성이다..
그것은 매우 반응성이 높고 인화성 물질이며 자연 발화성이기 때문에 자연적으로 발화 될 수 있습니다. 이 세 가지 조건은이 기사의 마지막 섹션에서 언급 할 보안 위험을 나타냅니다..
용도
수소 저장
수소화 마그네슘은 다음 화학 반응을 통해 물과 쉽게 반응하여 수소 가스를 형성합니다.
MgH2+2H2O → 2H2+Mg (OH)2
또한이 물질은 287 ° C의 온도와 1 bar의 압력에서 다음과 같이 분해됩니다 :
MgH2→ Mg + H2
따라서, 수소 저장 매체로서 그 사용 및 수송을위한 마그네슘 하이드 라이드의 사용이 제안되어왔다.
일정량의 금속 마그네슘의 수소화 및 탈수 소화는 가스 상태의 수소를 운송하는 방법으로 제안되어 운송시 누출이없고 고압 용기를 사용하는 것보다 안전하고 실용적인 방법을 제시합니다..
수소화 및 탈수소 반응
마그네슘 수 소화물의 분해 온도가 그 사용에 대한 제한 요소 임에도 불구하고, 수소화 반응 및 탈수 소화 반응의 동역학을 향상시키는 방법이 제안되었다. 그 중 하나는 볼 밀을 사용하여 마그네슘 입자의 크기를 줄이는 것입니다.
진흙
또한, 원하는 수소를 얻기 위해 물과 반응하는 진흙 형태 (분말 또는 다른 고체 입자보다 관리 및 안전)의 형태로 마그네슘 하이드 라이드를 생성하는 시스템이 제안되었다.
이전에 명명 된 슬러지는 오일의 보호 층으로 보호되고 물질의 손실없이 일관성을 유지하고 환경으로부터 습기를 흡수하지 않도록 분산제에 부유 된 미세하게 갈라진 수 소화물로 형성 될 것으로 추정됩니다..
이 슬러지는 일반적인 디젤, 가솔린 또는 워터 펌프를 통해 펌핑 될 수있어 경제적 인 제안을 효율적으로 만들 수 있다는 장점이 있습니다.
연료 전지
마그네슘 하이드 라이드는 첨단 연료 전지의 생산 및 배터리 및 에너지 저장 장치의 구현에 사용될 수 있습니다..
교통 및 에너지
지난 수십 년 동안 수소를 에너지 원으로 사용하는 것이 고려되었습니다. 연료로 수소를 주입하려면 안전하고 가역적 인 저장 시스템을 찾고 높은 부피 용량 (단위 부피당 수소의 양)과 중량 측정 단위 (단위 질량 당 수소의 양).
알킬화
알킬화 (CH 알킬기를 첨가3R)의 저농도 및 수 소화물의 융점보다 높은 온도에서 -OH 기의 존재가있는 염기성 매질에서의 유기 화합물.
이 경우, 수소화 마그네슘 (MgH2), 물을 형성하는 -OH기에 결합한다. 유리 마그네슘은 탄화수소 사슬에 결합하려는 알킬 분자에 종종 수반되는 할로겐을받을 수있다.
위험
물과의 반응
이미 언급했듯이, 마그네슘 하이드 라이드는 물과 매우 쉽고 강력하게 반응하는 물질로 고농도로 폭발 할 수있는 능력을 나타냅니다.
이것은 발열 반응이 분해 반응에서 방출 된 수소 가스를 점화시키기에 충분한 열을 발생시켜 다소 위험한 연쇄 반응을 일으키기 때문에 발생합니다..
그것은 자연 발화성이다.
수소화 마그네슘은 자연 발화성이기 때문에 습한 공기가있는 곳에서 자발적으로 발화 할 수 있으며 산화 마그네슘과 물을 형성합니다.
흡입시 고체 상태 또는 증기와의 접촉이 바람직하지 않습니다. 자연 상태의 물질과 분해 된 물질로 인해 심각한 상해 또는 사망까지 발생할 수 있습니다.
그것은 물 및 그것의 오염과 접촉하여 부식성 용액을 생성 할 수 있습니다. 피부와 눈에 접촉하는 것은 권장되지 않으며 점막에 자극을 유발합니다..
마그네슘 하이드 라이드가 암, 생식 결함 또는 기타 신체적 또는 정신적 결과와 같은 만성 건강에 영향을 줄 수 있음이 입증되지는 않았지만,이를 치료할 때 보호 장비를 사용하는 것이 좋습니다 (특히 호흡기 또는 마스크, 미세 먼지 특성).
이 물질로 작업 할 때, 공기의 습도는 낮은 수준으로 유지되어야하며, 모든 점화원을 소화하고 드럼이나 다른 용기 용기로 운반해야합니다..
폭발 가능성이 현저하게 감소하므로 피할 수있을 때 항상이 물질의 농도가 큰 작업을 피해야합니다.
마그네슘 하이드 라이드가 흘러 나오면 작업 공간을 격리하고 먼지를 진공 청소기로 수거해야합니다. 드라이 스위핑 방법을 사용하지 마십시오. 수 소화물과의 반응 기회를 증가시킨다..
참고 문헌
- Zumdahl, S. S. (1998). Britannica 백과 사전. britannica.com에서 가져온.
- PubChem. (2005). PubChem 오픈 화학 데이터베이스. pubchem.ncbi.nlm.nih.gov에서 가져온 것.
- Safe Hydrogen, L. (2006). 녹색 자동차 대회. greencarcongress.com에서 가져온.
- Chemicals, C. (n.d.). 카메오 케미칼. cameochemicals.noaa.gov에서 가져온.
- Services, N.J. (1987). 뉴저지 보건 및 노인 복지부. nj.gov에서 가져온 것.


