화학 활성화 에너지 구성, 계산
그 화학적 활성화 에너지 (동역학 연구의 관점에서) 화학 반응을 시작하는 데 필요한 최소한의 에너지를 말합니다. 화학 동역학에서의 충돌 이론에 따르면, 움직이는 모든 분자는 일정량의 운동 에너지를 가지고 있다고합니다.
이것은 운동 속도가 빠를수록 운동 에너지의 크기가 커짐을 의미합니다. 이러한 의미에서, 빠른 움직임을 지닌 분자는 그 자체로 단편으로 나뉘어 질 수 없으므로, 화학 반응이 일어날 수 있도록 다른 분자와 충돌이 발생해야합니다.
분자간에 충돌이 발생하면이 운동 에너지의 일부가 진동 에너지로 변환됩니다. 마찬가지로 프로세스의 시작 부분에서 운동 에너지가 높으면 충돌에 참여하는 분자가 너무 커서 어떤 화학 결합이 깨지게됩니다..
이 연결 끊김은 반응물을 제품으로 변형시키는 첫 번째 단계입니다. 즉, 이들의 형성에. 다른 한편으로,이 과정의 초기에 운동 에너지가 작은 크기라면 분자가 "반동 (rebound)"현상을 일으켜 실질적으로 완전히 분리됩니다..
색인
- 1 구성 요소는 무엇입니까??
- 1.1 활성화 된 단지
- 2 계산 방법?
- 2.1 화학 반응의 활성화 에너지 계산
- 3 활성화 에너지는 반응 속도에 어떻게 영향을 미칩니 까??
- 4 활성화 에너지의 계산 예
- 5 참고
그것은 무엇으로 이루어 집니까??
이전에 설명한 화학 반응을 시작하기 위해 분자 사이의 충돌 개념에서 시작하여 충돌이 발생하는 데 필요한 최소한의 에너지가 있다고 말할 수 있습니다.
에너지 값이 필요한 최소값보다 작다면, 단순히이 에너지가 없을 때, 관련 종은 대부분 그대로 유지 및 발생하지 않음을 의미 충돌, 제출 후 분자 사이에 변경을 수 없습니다 이 충격으로 인한 변화.
이 순서로 생각하면, 분자들이 충돌 한 후에 변화가 일어나기 위해 필요한 최소한의 에너지를 활성화 에너지.
즉, 쇼크에 관여하는 분자는 화학 반응이 발생할 수 있도록 활성화 에너지와 같거나 큰 크기의 전체 운동 에너지 양을 가져야합니다.
또한 많은 경우 분자들이 충돌하여 일시적으로 존재하기 때문에 활성화 된 복합체 (active complex)라고 불리는 새로운 종 (species)을 "이행 상태 (transition state)"라고도 부릅니다.
이것은 충돌로 인해 그리고 반응 생성물이 형성되기 전에 반응물 종에 의해 야기된다.
활성화 된 단지
상기 언급 된 활성화 된 착물은 매우 낮은 안정성을 가지지 만, 차례로 많은 양의 포텐셜 에너지를 갖는 종을 형성한다.
다음 다이어그램은 생성물에 대한 반응물의 변형을 보여 주며, 생성 된 활성화 된 복합체의 에너지 크기가 반응물 및 생성물의 에너지 크기보다 상당히 크다는 것을 나타냅니다..
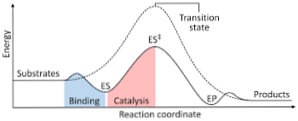
반응 종결시 생성물이 반응 물질보다 더 큰 안정성을 갖는다면, 에너지의 방출은 열의 형태로 발생하여 발열 반응을 일으킨다..
반대로, 반응물이 생성물보다 더 큰 크기의 안정성을 가져 오는 경우, 이는 반응 혼합물이 주위로부터의 열의 형태로 에너지의 흡수를 나타내어 흡열 반응을 일으킨다는 것을 의미한다..
마찬가지로 하나의 경우 또는 다른 하나가 발생하면 반응의 진행 또는 진행에 반응하는 시스템의 잠재적 인 에너지가 그려지는 그림과 같이 이전에 표시된 것과 같이 다이어그램을 구성해야합니다..
이렇게하면, 반응이 진행될 때 일어날 수있는 잠재적 인 에너지 변화가 얻어지고 반응물은 생성물.
계산 방법?
화학 반응의 활성화 에너지는 반응의 속도 상수와 밀접한 관련이 있으며,이 상수의 온도에 대한 의존성은 아 레니 우스 (Arrhenius) 방정식으로 표현됩니다.
k = Ae-예 / RT
이 식에서 k 반응의 속도 상수 (온도에 의존 함) 및 매개 변수 A 그것은 주파수 인자 (frequency factor)라고 불리우며, 그것은 분자간 충돌의 빈도를 측정합니다.
그 부분을 위해, 전자 일련의 자연 대수를 나타냅니다. 그것은 활성화 에너지의 음의 지수와 동등한 힘으로 상승한다 (에아)은 가스 상수 (R) 및 절대 온도 (T) 고려해야 할 시스템.
주파수 계수는 넓은 온도 범위에서 특정 반응 시스템에서 상수로 간주 될 수 있습니다.
이 수식은 1884 년 네덜란드의 태생의 화학자 인 야코 뷔스 헨리 퀴스 판트 호프에 의해 처음 주장,하지만 누가 과학적 타당성을 포기하고 그 전제는 1889 년, 스웨덴 화학자 스 반테 아 레니 우스 기원했다 해석되었다.
화학 반응의 활성화 에너지 계산
Arrhenius 방정식은 반응의 속도 상수와 분자 사이의 충돌 빈도 사이에 존재하는 직접 비례 관계를 지적합니다.
또한이 방정식은 방정식의 각 측면에 자연 대수의 특성을 적용하여보다 편리하게 표현할 수 있습니다.
ln k = ln A - Ea / RT
선의 방정식 (y = mx + b)을 얻기 위해 항을 재정렬 할 때 다음식이 성립됩니다.
ln k = (- Ea / R) (1 / T) + ln A
1 / T에 대하여 라그 k는 Y 좌표를 나타낸다 얻어진 직선, LN k의 플롯을 구성 할 때, (-Ea / R)은 라인 (m)의 기울기를 나타내고, (1 / T) 좌표 x를 나타내고, lnA는 종좌표 (b)의 축과의 교차점을 나타내고,.
알 수 있듯이,이 계산으로 인한 기울기는 -Ea / R의 값과 같습니다. 즉,이 식을 사용하여 활성화 에너지의 값을 얻으려는 경우 간단한 제거를 수행해야하며 다음과 같은 결과가 발생합니다.
Ea = -mR
여기서 우리는 m의 값을 알고 R은 8.314 J / K · mol과 같은 상수이다..
활성화 에너지는 반응의 속도에 어떤 영향을 미칩니 까??
활성화 에너지의 이미지를 만들려고 할 때, 저에너지 분자 사이에서 반응이 일어나지 않는 장벽으로 간주 될 수 있습니다.
일반적인 반응에서 반응 할 수있는 분자의 수가 상당히 많아지기 때문에 속도와 이에 상응하는 분자의 운동 에너지는 매우 다양 할 수 있습니다.
일반적으로 충돌을 경험하는 분자 전체의 소량 (운동 속도가 더 빠른 분자)만으로 활성화 에너지의 크기를 극복 할 수있는 충분한 운동 에너지를 제공합니다. 그래서,이 분자들은 적절하고 반응의 일부가 될 수 있습니다..
레니 우스 식에 의해, 절대 온도에 의해 활성화 에너지 및 기체 상수의 곱의 비율 앞에 음의 부호는, 속도 상수 감소 선물은 활성화 에너지의 증가를 갖는 것을 의미 온도가 상승 할 때의 성장.
활성화 에너지의 계산 예
상기 아 레니 우스의 식에있어서, 그래프를 구성하여 활성화 에너지를 계산하는 아세트 알데히드의 분해 반응에 대한 속도 상수는 다섯 가지의 온도에서 측정하고, 활성화 에너지를 결정하는 것이 바람직하다이어야 반응식은 다음과 같이 표현된다.
CH3CHO (g) → CH4(g) + CO (g)
5 가지 측정 값의 데이터는 다음과 같습니다.
k (1 / M1/2· S) : 0.011 - 0.035 - 0.105 - 0.343 - 0.789
T (K) : 700-730-760-790-810
우선,이 비밀을 해결하고 활성화 에너지를 결정하는 것은 직선을 구하여 여기서 1 / T (X 대 Y) 대 라그 (k)의 플롯을 작성 기울기를 가지고의 EA 값을 찾을 수있다, 설명 된대로.
Arrhenius 방정식 [ln k = (- Ea / R) (1 / T) + ln A]에 따라 측정 데이터를 변환하면 각각 다음 값이 y와 x에서 발견됩니다.
ln k : (-4.51) - (-3.35) - (-2.254) - (-1.070) - (-0.237)
1 / T (K-1) : 1.43 * 10-3 - 1.37 * 10-3 - 1.32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
이 값들과 컴퓨터 또는 계산기에서 기울기의 수학적 계산을 통해 m = (Y2-Y1) / (X2-X1) 또는 선형 회귀 방법을 사용하여 - m = -Ea / R = -2.09 * 104 K : 그럼.
Ea = (8.314 J / K · mol) (2.09 * 104 K)
= 1.74 * 105 = 1.74 * 102 kJ / mol
그래픽 방식을 통한 활성화의 다른 에너지를 결정하기 위해 유사한 절차가 수행됩니다.
참고 문헌
- 위키 백과. (s.f.). 활성화 에너지. en.wikipedia.org에서 검색
- Chang, R. (2007). 화학, 9 판. 멕시코 : McGraw-Hill.
- Britannica, E. (s.f.). 활성화 에너지. britannica.com에서 검색 함
- Moore, J.W. and Pearson, R.G. (1961)]에 기재되어있다. 운동 및 메커니즘. books.google.co.ve에서 가져옴
- Kaesche, H. (2003). 금속 부식 : 물리 화학적 원리와 현재의 문제. books.google.co.ve에서 가져옴


