사이클로 헥센 구조, 특성, 합성 및 용도
그 시클로 헥센 분자식이 C 인 알켄 또는 고리 형 올레핀6H10. 그것은 무색의 액체로 이루어지며 물에 녹지 않으며 많은 유기 용제와 섞일 수 있습니다. 그것은 가연성이 특징이며, 자연에서 일반적으로 콜타르에서 발견됩니다..
시클로 헥센은 벤젠의 부분적인 수소화 및 알코올 시클로 헥산 올의 탈수 반응에 의해 합성된다. 다시 말해 녹슨 형태입니다. 다른 시클로 알켄과 마찬가지로, 그것은 친 전자 성 첨가 및 자유 라디칼의 반응을 겪는다; 예를 들어 할로겐화 반응.
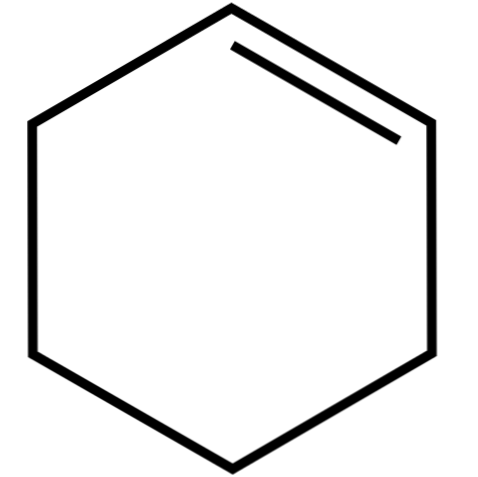
이 환상 알켄 (상) 형태 (증류에 의해 분리되지 않음) 저급 알코올, 아세트산과 공비 혼합물. 그것은 햇빛과 자외선의 작용으로 분해되기 때문에 장기간 보관해도 그다지 안정하지 못합니다..
시클로 용매로 사용하므로 높은 옥탄 가솔린 안정제 및 오일 추출 많은 애플리케이션을 갖는다.
그러나 가장 중요한 것은 그것이 시클로 수많은 화합물을 제조하기위한 중간 원료 있다는 포함한 유용한 : 시클로 헥사 논 등이, 아 디프 산, 말레 산, 시클로 헥산, 부타디엔, 시클로 헥실 카르 복실 산,.
색인
- 1 시클로 헥센의 구조
- 1.1 분자간 상호 작용
- 2 속성
- 2.1 화학 이름
- 2.2 분자량
- 2.3 외관
- 2.4 냄새
- 2.5 끓는점
- 2.6 융점
- 2.7 인화점
- 2.8 물 용해도
- 2.9 유기 용매에서의 용해도
- 2.10 밀도
- 2.11 증기 밀도
- 2.12 증기압
- 2.13 자동 점화
- 2.14 분해
- 2.15 점도
- 2.16 연소열
- 2.17 기화열
- 2.18 표면 장력
- 2.19 중합
- 2.20 악취 문턱
- 2.21 굴절률
- 2.22 pH
- 2.23 안정성
- 2.24 반응
- 3 요약
- 4 용도
- 5 가지 위험
- 6 참고 문헌
시클로 헥센의 구조
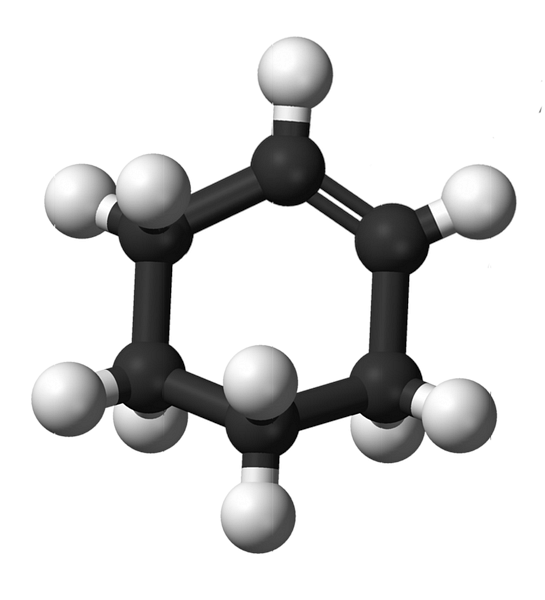
구체와 막대의 모형을 가진 cyclohexene의 구조는 위의 이미지에 나와 있습니다. 하나는 화합물의 불포화 상태 인 6 개의 탄소 고리와 이중 결합을 볼 수 있습니다. 이 관점에서 볼 때 반지는 평평한 것 같습니다. 그러나 전혀 아니다..
우선, 이중 결합의 탄소는 sp 하이브리드 화를 갖는다2, 삼각 평면 기하학을 갖습니다. 그러므로이 두 탄소와 그것들에 인접한 탄소들은 같은 평면에있다. 반대쪽 말단 (이중 결합에 대한)의 두 개의 탄소는 상기 평면 위 및 아래에있다.
아래쪽 이미지는 방금 설명한 내용을 완벽하게 보여줍니다..

블랙 밴드는 4 개의 탄소로 구성되어 있습니다 : 이중 결합의 두 개와 인접한 다른 탄소. 노출 된 관점은 관객이 이중 사슬 앞에서 자신의 눈을 오른쪽으로 향하게하면 얻을 수있는 관점입니다. 탄소가이 평면 위와 아래에 있음을 볼 수 있습니다..
cyclohexene 분자가 정적이 아니기 때문에, 두 개의 탄소가 교환됩니다 : 하나는 낮아지고 다른 하나는 평면 위로 올라갑니다. 그래서 당신은 그 분자가 행동 할 것을 기대할 것입니다..
분자간 상호 작용
시클로 헥센은 탄화수소이며 따라서 분자간 상호 작용은 런던의 분산력을 기반으로합니다.
분자는 비극성 때문 영구 쌍극자 모멘트없이이며, 그 분자량은 응집력 액체를 유지에서 가장 기여 요인이다.
또한, 이중 결합은 다른 탄소와 같은 유연성으로 이동할 수있는 상호 작용의 정도를 증가시키고, 이것은 이웃 분자들 사이의 상호 작용을 촉진한다. 이러한 이유로 시클로 헥센은 사이클로 헥산 (81 ℃)보다 약간 더 높은 비등점 (83 ℃).
등록 정보
화학 이름
사이클로 헥센, 테트라 하이드로 벤젠.
분자량
82,146 g / mol.
외관
무색의 액체.
냄새
달콤한 냄새.
끓는점
83 ºC에서 760 ㎜Hg.
융점
-103.5 ºC.
점화 점
-7ºC (밀폐 된 컵).
물에 대한 용해도
사실상 불용성 (213 mg / L).
유기 용제의 용해도
에탄올, 벤젠, 사염화탄소, 석유 에테르 및 아세톤과 섞일 것. 그것은 석탄 allotropes의 일부처럼 무극 화합물을 용해 수있을 것으로 예상된다.
밀도
0.810 g / cm3 20ºC.
증기 밀도
2.8 (대기와 관련하여 1과 같음).
증기 압력
25 ºC에서 89 mmHg.
자동 점화
244 ºC.
분해
햇빛과 자외선의 작용하에 우라늄 염의 존재 하에서 분해.
점도
25 ºC에서 0.625 mPascal.
연소열
25 ° C에서 3,751.7 kJ / mol.
기화열
25 ºC에서 30.46 kJ / mol.
표면 장력
26.26 mN / m.
중합
그것은 특정 조건 하에서 중합 할 수있다..
악취 문턱
0.6 mg / m3.
굴절률
20 ℃에서 1.4465.
pH
20 ° C에서 7-8.
안정성
사이클로 헥센은 장기 보관시 매우 안정하지 못합니다. 빛과 공기에 노출되면 과산화물이 생성 될 수 있습니다. 마찬가지로, 그것은 강한 산화제와는 양립 할 수 없다..
반응
-사이클로 알켄은 주로 친 전자 성 및 유리 라디칼 모두 부가 반응을 경험한다.
-브롬과 반응하여 1,2- 디 브로 모시 클로 헥산.
-과망간산 칼륨 (KMnO)의 존재 하에서 빠르게 산화된다.4).
-퍼 옥시 벤조산의 존재하에 에폭 사이드 (시클로 헥센 옥사이드)를 생성 할 수있다.
합성
시클로 헥산은 시클로 헥산 올의 산성 촉매에 의해 생성됩니다 :
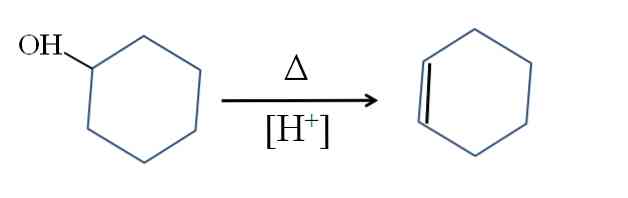
기호 Δ는 산성 매질 (OH) 그룹에서 물 분자로서 OH 그룹의 배출을 촉진 시키는데 필요한 열을 나타낸다2+).
시클로 헥센은 또한 벤젠의 부분적인 수소화에 의해 생성된다; 즉 이중 결합 중 두 개가 수소 분자를 추가합니다.
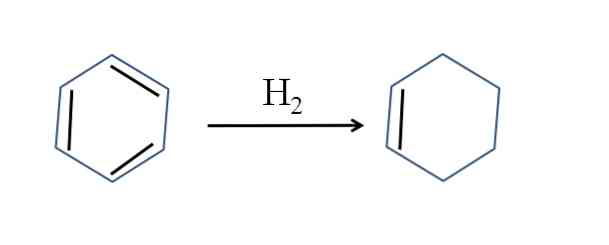
반응은 단순 해 보일지라도 H의 큰 압력이 필요하다.2 및 촉매.
용도
-그것은 유기 용제로서 유용합니다. 또한, 아 디프 산, 아 디프 알데하이드, 말레 산, 시클로 헥산 및 시클로 헥실 카르 복실 산의 제조 원료 인.
-이는 의약품 및 고무 첨가물의 제조에 중개자로 사용되는 화합물 인 시클로 헥산 염화물의 생산에 사용됩니다..
-시클로 헥산은 시클로 헥사 논의 합성 원료, 의약품, 살충제, 향수 및 염료 제조 원료로도 사용됩니다..
-시클로 헥센은 계면 활성제 및 유화제로 사용되는 화합물 인 아미노 시클로 헥산 올의 합성에 관여합니다..
-또한, 시클로 헥센은 부타디엔 실험실에서의 제조에 사용될 수있다. 후자의 화합물은 합성 고무의 제조, 자동차 용 타이어의 제조에 사용되며, 또한 아크릴 플라스틱의 제조에도 사용됩니다.
-사이클로 헥센은 라이신, 페놀, 폴리 시클로 올레핀 수지 및 고무 첨가제의 합성을위한 원료입니다..
-그것은 높은 옥탄 가솔린의 안정제로 사용됩니다.
-방수 코팅, 균열 저항성 필름 및 코팅 용 바인딩 바인더의 합성에 관여.
위험
시클로 헥센은 매우 독성이 강한 화합물은 아니지만 접촉으로 인해 피부와 눈이 붉어 질 수 있습니다. 흡입하면 기침과 졸음이 생길 수 있습니다. 또한, 섭취하면 졸음, 호흡 곤란 및 메스꺼움을 유발할 수 있습니다.
Cyclohexene은 위장관에서 잘 흡수되지 않으므로 섭취로 인한 심각한 전신적인 영향은 없습니다. 가장 큰 합병증은 호흡기에 의한 열망으로서 화학적 폐렴을 일으킬 수 있습니다..
참고 문헌
- 조셉 F. 치앙, 사이먼 하비 바우어. (1968). cyclohexene의 분자 구조. J. Am. Chem. Soc. 1969, 91, 8, 1898-1901.
- Karry Barnes. (2019). 사이클로 헥센 : 위험, 합성 및 구조. 공부해라. 원본 주소
- Morrison, R.T. and Boyd, R.N. (1987). 유기 화학 (5타 버전.). 편집 Addison-Wesley Iberoamericana.
- PubChem. (2019). 사이클로 헥센. 원본 주소 'pubchem.ncbi.nlm.nih.gov'
- 화학 도서. (2019). 사이클로 헥센. 원본 주소 'chemicalbook.com'
- 독물학 데이터 네트워크. (2017). 사이클로 헥센. Toxnet 원본 주소 'toxnet.nlm.nih.gov'
- Chemoxy. (s.f.). cyclohexene의 구조 공식은 다음과 같습니다. 원본 주소 'chemoxy.com'


