물질의 특성 (물리적 및 화학적)
그 물질의 특성 하나의 물질을 다른 물질과 구별하거나 구별하는 데 도움이되는 화학적 또는 물리적 특성입니다. 물리적 특성은 감각으로 관찰되는 물질의 특성입니다. 화학적 성질은 화학 반응 중에 물질이 한 물질에서 다른 물질로 어떻게 변하는지를 기술하는 특성입니다.
물질의 물리적 특성에는 밀도, 용해도, 융점, 색상 및 질량이 있습니다. 재료의 화학적 성질에는 인화성, 산과의 반응성 및 부식이 포함됩니다. 물질의 특성이 어떻게 요소를 확인하는 데 도움이되는지에 대한 몇 가지 예는 서로 다른 원소의 밀도를 비교하는 것입니다.
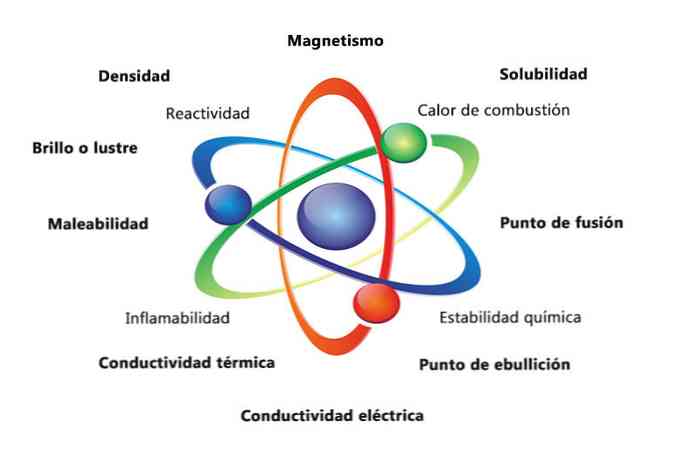
금과 같은 원소는 입방 센티미터 당 19.3 그램의 밀도를 가지지 만 유황의 밀도는 1.96 그램 / 세제곱 센티미터이다. 마찬가지로 물과 이소 프로필 알콜과 같은 물질의 융점도 다릅니다..
물질의 물리적 특성
물질의 물리적 성질은 물질의 화학적 성질을 변화시키지 않고 측정되거나 관찰 될 수있는 특성이다. 물리적 속성의 몇 가지 예는 다음과 같습니다.
- 밀도 : 물체가있는 물질의 양, 질량을 부피로 나눈 값.
- 자성 (magnetism) : 자석과 자성체 사이의 인력.
- 용해도 : 물질이 다른 물질에 얼마나 잘 녹을 수 있는지 측정.
- 융점 : 물질이 고체에서 액체로 변하는 온도.
- 끓는 점 : 물질이 액체에서 기체로 변하는 온도.
- 전기 전도도 : 전류가 물질을 얼마나 잘 움직이는 지의 척도입니다..
- 열전도도 : 물질이 열을 전달하는 속도.
- 가단성 (Malleability) : 여러 가지 방법으로 물질이 말리거나 빻아 질 수있는 능력.
- 광택 또는 광택 : 물체가 빛을 얼마나 쉽게 반사하는지.
물질의 화학적 성질
화학적 성질은 물질이 다른 성질을 가진 새로운 물질로 변화하는 능력을 기술합니다. 다음은 화학적 특성의 몇 가지 예입니다.
- 연소열 : 화합물이 산소와 완전 연소를 할 때 방출되는 에너지.
- 화학적 안정성 : 화합물이 물 또는 공기와 반응할지 여부를 나타냅니다 (화학적으로 안정한 물질은 반응하지 않음).
- 인화성 : 화염에 노출되었을 때 화합물이 연소하는 능력.
- 반응성 : 다른 물질과 상호 작용하고 하나 이상의 새로운 물질을 형성하는 능력.
물질의 물리적 상태
물질은 공간을 차지하고 질량이 있고 우리의 감각에 의해 감지 될 수있는 모든 것입니다. 물질은 물리적 상태에 따라 분류 할 수 있습니다 : 고체, 액체 및 기체.
1- 고체 및 그 특성
모든 고형물은 질량을 가지며, 공간을 차지하고, 정의 된 용적 및 모양을 가지며, 공간을 통과하지 않고 압축되거나 강체 형태를 가질 수 없습니다. 예로 나무, 책, 스폰지, 금속, 돌 등이 있습니다..
고형물에서는 물질의 작은 입자가 매우 가깝고 서로 닿아 있습니다. 입자들은 너무 가깝게 움직일 수 없기 때문에 입자 사이에 공간이 거의 없습니다..
2- 액체 및 그 특성
모든 액체는 질량이 있고, 공간을 차지하고, 정의 된 체적을 가지지 만 정의 된 모양을 가지지 않습니다 (그들이 컨테이너의 위치에 적응하기 때문에), 아주 작은 정도로 압축되어 공간을 통과 할 수 있습니다. 예로 우리는 물, 등유, 기름 등을 가지고 있습니다..
액체에서는 작은 입자의 물질이 조금 더 멀어지며 고체 사이에 더 많은 공간이 있고 서로 접촉하지 않습니다. 따라서 입자는 공간 사이를 이동할 수 있고, 다른 입자와 밀거나 충돌하여 방향을 끊임없이 바꿀 수 있습니다..
3- 가스 및 그 특성
모든 가스는 질량이 있고, 공간을 차지하고, 정의 된 용적이나 모양을 가지지 않으며, 큰 정도로 압축 될 수 있고 공간으로 확산 될 수 있습니다. 예를 들면 수소, 산소, 질소, 이산화탄소, 증기 등이 있습니다..
기체에서 물질의 작은 입자들은 훨씬 더 멀리 떨어져 있고, 액체들과 비교할 때 훨씬 더 많은 공간이 있고 서로 접촉하지 않습니다. 입자는 최대 자유도를 가지므로 방향을 끊임없이 변화시키는 다른 입자와 밀거나 충돌합니다..
물질의 상태 변화
물질은 고체 상태에서 액체 상태로 또는 그 반대로, 그리고 액체 상태에서 기체 상태로 또는 그 반대로 변환 될 수 있습니다. 이 전환은 물질의 상태 변화의 이름을 취하고 온도의 변화에 의해 발생합니다 :
퓨전
온도 상승에 의해 물질의 상태가 고체에서 액체로 변합니다. 고형물이 가열되면 열로 입자가 더 격렬하게 진동합니다.
융점에 도달하면, 고체 입자는 고정 된 위치에서 유지하는 정력의 힘을 극복하기에 충분한 운동 에너지를 가지며, 액체 입자의 작은 그룹을 형성하기 위해 끊어진다..
끓이거나 기화
온도 상승에 의한 액체 상태의 기체 상태 변화. 액체 물질이 가열되면 열로 입자가 더 빨리 움직입니다..
끓는점에 도달하면 액체 입자는 고정 된 위치에 고정시키는 인력을 극복하기에 충분한 운동 에너지를 가지며 개개의 기체 입자로 분리됩니다..
동결 또는 응고
온도가 낮아짐에 따라 액체 상태의 고체 상태로의 변화. 액체 물질이 냉각되면 입자가 많은 운동 에너지를 잃습니다. 응고점에 도달하면 입자는 움직이지 않고 고정 된 위치에서 진동하여 고체 입자가됩니다.
액화 또는 결로
온도가 낮아짐에 따라 가스 상태의 액체 상태로의 변화. 기체 물질이 냉각되면 입자는 많은 운동 에너지를 잃어서 서로 끌어 당겨 액체 입자가됩니다.
승화
일부 물질은 액체 상태를 거치지 않고 고체 상태에서 가스 상태로 직접 또는 그 반대로 바뀝니다. 이러한 고체 물질이 가열 될 때, 입자는 매우 빠르게 움직여 증기 나 기체를 완전히 분리하고, 그 반대의 경우는 기체 상태에서 고체 상태로 진행됩니다.
참고 문헌
- De Podesta, M. 물질의 특성 이해, 제 2 판. 영국 : Taylor & Francis.
- Goel A. 문제의 주. 뉴 델리 : 디스커버리 출판사.
- Moore J, Stanitski C. 분자 과학, 제 5 판. 스탬 포드 : Cengage Learning.
- Ramakrishna A. 자연의 문제, 제 1 판. 뉴 델리 : Goyal Brothers Prakashan.
- Reger D, Goode S, Ball D. Chemistry. 원칙과 실천, 제 3 판. 캐나다 : Brooks / Cole, Cengage Learning.
- Shapere D. Matter (물리학). 검색 기준 : accessscience.com.
- Singh L, Kaur M. Matter는 우리 주변에 있습니다. 인도 : S. Chand School.


