Topoisomerases 특성, 기능, 유형 및 억제 물
그 토포 이소 머라 제 디옥시리보 핵산 (DNA)의 토폴로지를 변형시키는 이성화 효소 (isomerase) 효소의 일종으로 권선과 수퍼 코일로 풀리는 것과.
이러한 효소는 DNA의 비틀림 응력을 완화시키는 데있어 특별한 역할을하므로 복제, mRNA의 재조합 및 DNA 재조합과 같은 중요한 과정이 일어날 수 있습니다..

Topoisomerase 효소는 진핵 세포와 원핵 세포 모두에 존재합니다. 그 존재는 DNA 구조가 정보에 접근 할 수 있도록 제시 한 한계 (핵산 서열에 저장 됨)를 평가할 때 과학자 Watson과 Crick에 의해 예측되었다..
topoisomerases의 기능을 이해하기 위해서는, DNA가 이중 나선의 안정된 구조를 가지고 있다고 생각해야합니다..
이 선형 사슬은 2-deoxyribose가 phosphodiester bond 5'-3 '에 의해 결합되어 있고, 나선형 계단의 계단처럼 내부에 질소 성 염기가있다..

DNA 분자의 토폴로지 연구는 비틀림 장력에 따라 몇 가지 형태를 취할 수 있음을 보여주었습니다. 이완 상태에서 압축 상태를 허용하는 여러 가지 감기 상태.
서로 다른 형태의 DNA 분자를 토포 이성질체라고합니다. 따라서, 우리는 토포 아이소 머라 제 I 및 II가 DNA 분자의 비틀림 장력을 증가 또는 감소시켜 다른 토포 이소 머를 형성 할 수 있다고 결론 내릴 수있다.
가능한 DNA 토포 이성질체 중에서 가장 일반적인 형태는 초 코일 링 (supercoiling)이며 매우 콤팩트합니다. 그러나 DNA의 이중 나선도는 여러 분자 과정에서 토포 이소 머라 제에 의해 풀어 져야합니다.
색인
- 1 특성
- 1.1 일반적인 행동의 메커니즘
- 1.2 Topoisomerases와 세포주기
- 2 함수
- 2.1 유전 물질의 조밀 한 저장
- 2.2 유전 정보에의 접근
- 2.3 유전자 발현의 조절
- 2.4 토포 이소 머라 제 II의 특이성
- topoisomerases의 3 가지의 유형
- 3.1-Topoisomerases 유형 I
- 3.2 - 토포 이소 메라 이제 유형 II
- 3.3 - 인간 토포 이소 머라 제
- 4 Topoisomerase 억제제
- 4.1- 화학 공격의 표적으로 삼는 Topoisomerases
- 4.2- 억제의 유형
- 4.3 - Topoisomerase 억제 물 약
- 5 참고
특징
일반적인 행동의 메커니즘
일부 토포 이소 머라 아제는 음성 DNA 수퍼 코일 또는 DNA 수퍼 코일 모두를 진정시킬 수 있습니다 : 양성 및 음성.
순환 이중 가닥 DNA가 종축에서 풀리고 왼손 회선이 발생하면 (시계 방향으로), 이는 음의 수퍼 코일로 불린다. 턴이 시계 방향 (반 시계 방향) 인 경우, 그것은 긍정적으로 슈퍼 코일입니다.

기본적으로 토포 이소 머라 아제는 :
-반대 가닥 절단 (topoisomerase type I)을 통해 DNA 가닥의 통과를 촉진합니다..
-완전한 이중 나선의 통과를 자체적으로 분할하거나 다른 다른 이중 나선 (topoisomerase type II)의 분리를 통해 촉진합니다..
요약하면, 토포 이소 머라 제는 포스의 하나로 채권, 또는 DNA를 구성하는 두 가닥의 분열을 통해 역할을합니다. 이어서 이중 나선 (토포 이소 머라 제 I) 가닥 또는 두 개의 이중 나선 (토포 이소 머라 제 II)를 권취 상태를 변경하고, 마지막으로 절단 된 단부 넥타이 또는 바인딩 반환.
Topoisomerases 및 세포주기
토포 이소 머라 제 I은 S 상 (DNA 합성)시 높은 활성을 갖는 효소이지만, 세포주기 단계에 의존하는 것으로 간주되지 않으며.
토포 이소 머라 제 Ⅱ 활성은 세포 성장의 대수 단계 및 급성 종양 세포에서보다 활성 인 반면.
기능들
topoisomerases를 암호화하는 유전자의 변경은 세포에 치명적이며, 이러한 효소의 중요성을 보여줍니다. 토포 이소 메라 제가 참여하는 과정은 다음과 같습니다 :
유전 물질의 컴팩트 한 보관
Topoisomerases는 DNA coiling과 supercoiling을 생성하여 비교적 적은 양의 많은 양의 정보를 찾을 수 있기 때문에 유전자 정보의 저장을 용이하게합니다..
유전 정보에 대한 접근성
토포 아이소 머라 제 (topoisomerases)와 그 독특한 특성이 없다면 DNA에 저장된 정보에 접근하는 것이 불가능할 것입니다. 이것은 토포 이소 머라 아제가 복제, 전사 및 재조합 과정에서 DNA의 이중 나선에서 발생하는 비틀림에 의해 주기적으로 긴장을 풀기 때문입니다.

이러한 과정에서 발생하는 비틀림으로 인한 장력이 풀리지 않으면 유전자 발현의 결함, 원형 DNA 또는 염색체의 중단, 세포 사멸을 일으킬 수 있습니다.
유전자 발현의 조절
DNA 분자의 입체 구조 변화 (3 차원 구조)는 DNA 결합 단백질과 상호 작용할 수있는 특정 영역을 외부로 노출시킵니다. 이 단백질은 유전자 발현 (양성 또는 음성)의 조절 기능을 가지고 있으며,.
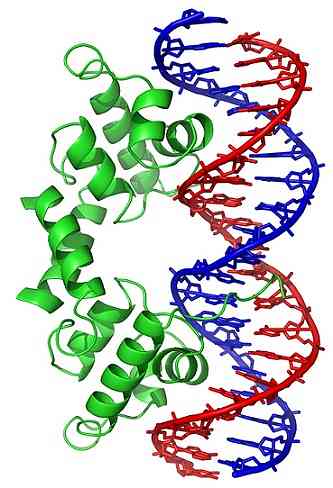
따라서, 토포 이소 머라 제 (topoisomerase)의 작용에 의해 생성되는 DNA 와인딩 상태는 유전자 발현의 조절에 영향을 미친다.
토포 아이소 머라 제 II의 특이성
토포 아이소 머라 제 II는 염색체의 축합 및 탈 축합과 유사 분열 동안의 딸 DNA 분자의 분리를 위해 필요하다..
이 효소는 구조 단백질이며 계면 중 세포 핵 기질의 주성분 중 하나이다.
토포 이소 머라 제의 유형
하나 또는 두 개의 DNA 가닥을 절단 할 수 있는지에 따라 두 가지 주요 유형의 토포 이소 머라 제가 존재합니다.
-토포 아이소 머라 제 I 형
단량체
타입 I 토포 아이소 머라 제는 전사 중에 포크의 이동에 의해 그리고 복제 및 유전자 재조합의 과정 중에 생성되는 음성 및 양성 수퍼 코일을 완화시키는 모노머이다.
유형 I의 토포 이소 머라 제는 유형 1A와 유형 1B로 세분 될 수 있습니다. 후자는 인간에서 발견되는 것들이며 supercoiled DNA를 완화시키는 역할을한다..
활성 사이트의 티로신
Topoisomerase 1B (Top1B)는 765 개의 아미노산을 4 개의 특정 도메인으로 나누어 구성되어 있습니다. 이들 도메인 중 하나는 티로신 (Tyr7233)을 갖는 활성 부위를 함유하는 고도로 보존 된 영역을 갖는다. 모든 토포 이소 메라 제는 그들의 활성 부위에 전체 촉매 과정에서 기본적인 역할을하는 티로신을 나타낸다.
행동 메커니즘
활성 부위의 티로신은 DNA 가닥의 3'- 포스페이트 말단과 공유 결합을 형성하여 잘라내어 효소에 부착 된 상태로 유지하면서 절제를 통해 또 다른 DNA 가닥을 통과시킨다.
절제 된 가닥을 통한 DNA의 다른 가닥의 통과는 DNA 이중 나선의 개방을 생성하는 효소의 구조적 변형에 의해 달성된다.
그런 다음 토포 아이소 머라 제 I은 초기 형태로 되돌아 가서 다시 말단을 묶는다. 이것은 효소의 촉매 부위에서 DNA 쇄의 역전 과정에 의해 발생합니다. 마지막으로, 토포 이소 머라 제는 DNA 가닥을 방출한다.
DNA 라이 게이션 속도는 분자의 안정성과 게놈의 완전성을 보장하는 절제율보다 높습니다..
요약하면, 토포 이소 머라 제 I 형은 다음을 촉매한다 :
- 가닥 절단.
- 분할을 통한 다른 가닥의 통과.
- 분할 끝의 결찰.
-Topoisomerases II 형
Diméricas
타입 II 토포 이소 머라 제는 DNA의 두 가닥을 절단하여 전사 및 다른 세포 과정 중에 생성되는 슈퍼 코일을 이완시키는 이량 체 효소이다.
부양 가족++ 및 ATP
이러한 효소는 마그네슘 (Mg++) 또한 ATP 효소 덕분에 ATP 삼 인산염 연결의 붕괴에서 오는 에너지가 필요합니다..
티로신을 가진 2 개의 활성 사이트
인간 토포 아이소 머라 제 II는 효모와 매우 유사하다 (사카로 마이 세스 세레 비시 애), 두 단량체 (하위 조각 A와 B)로 구성되어 있습니다. 각각의 단량체는 ATPase 도메인을 갖고, 서브 단편에서는 DNA가 결합 할 수있는 티로신 활성 사이트 (782)를 갖는다. 따라서, 두 가닥의 DNA를 토포 아이소 머라 제 II에 결합시킬 수 있습니다.
행동 메커니즘
토포 아이소 머라 제 II의 작용 메카니즘은 토포 아이소 머라 제 I에 대해 기술 된 것과 동일하며, 2 개의 DNA 사슬이 절단되고,.
토포 아이소 머라 제 II의 활성 부위에서, 단백질의 단편이 안정화된다 (티로신과의 공유 결합을 통해). 이중 나선 "단편 G"라고 불리는 DNA의 이 단편은 절단되고 공유 결합에 의해 활성 부위에 결합 된 채로 유지된다.
그런 다음 효소는 ATP의 가수 분해에 의존하는 효소의 입체 구조 변화 덕분에 "T 조각"이라고 불리는 DNA의 또 다른 단편이 절단 된 단편 "G"를 통과하게합니다.
토포 아이소 머라 제 II는 "단편 G"의 두 말단을 결합하고 마지막으로 초기 상태를 회복하여 단편 "G"를 방출한다. 그런 다음 DNA는 비틀림 장력을 완화시켜 복제 및 전사 과정을 수행합니다.
-인간 토포 이소 머라 제
인간 게놈은 다섯 토포 이소 머라 있습니다 TOP1, top3α, top3β (유형 I)를; 및 top2α, top2β (II 형). 가장 관련성이 인간의 토포 이소 머라 제는 TOP1 (토포 이소 머라 아제 형 IB) 및 2α 있습니다 (토포 아이소 머라 제 II).
Topoisomerase 억제 물
-화학 공격의 대상이되는 토포 아이소 머라 제
topoisomerases에 의해 촉매 작용을하는 과정이 세포의 생존에 필요하기 때문에,이 효소는 악성 세포에 영향을 미치는 공격의 좋은 표적이됩니다. 이를 위해, 토포 이소 머라 제는 많은 인간 질병의 치료에서 중요하게 여겨지고 있습니다.
국소 이성화 효소와 상호 작용하는 약물은 현재 널리 화학 요법 (신체의 다른 기관에서) 암 세포에 대한 에이전트 및 병원균으로 연구한다.
-억제 유형
Topoisomerase 활동 억제 약물은 :
- DNA 로의 섭취.
- topoisomerase 효소에 영향을 미칩니다..
- DNA- 토포 이소 머라 아제 복합체가 안정화되는 동안 효소의 활성 부위 근처의 분자에 인터리빙.
효소의 촉매 부위의 티로신에 대한 DNA의 결합에 의해 형성되는 일시적인 복합체의 안정화는 절제 된 단편의 결합을 방지하여 세포 사멸을 초래할 수있다.
-토포 이소 머라 제 억제제
토포 아이소 머라 제를 억제하는 화합물 중에서 다음과 같다.
항 종양 항생제
항생제는 종양 세포의 성장을 막기 때문에 대개 암세포의 DNA를 간섭함으로써 암에 대해 사용됩니다. 항암제 (항암제)라고도합니다. 예를 들어, 악 티노 마이신 D는 토포 아이소 머라 제 II에 영향을 미치고 소아 및 횡문근 육종에서의 윌름 종양에 사용된다.
안트라 사이클린
Anthracyclines은 항생제 중에서 가장 효과적인 항암제이며 가장 광범위합니다. 그들은 폐암, 난소, 자궁, 위, 방광, 유방, 백혈병 및 림프종의 치료에 사용됩니다. DNA의 인터 칼 레이션에 의해 토포 이소 머라 제 II에 영향을 미치는 것으로 알려져있다.
actinobacteria에서 분리 된 첫 번째 안트라 사이클린 (Streptomyces peucetius) daunorubicin이었다. 그 후 실험실에서 독소루비신이 합성되었으며, 이제는 에피 루비 신과 이데 루비 신이 사용됩니다..
안트라 퀴논
안트라 퀴논 또는 안트라센 디온은 안트라 시린 (anthracyclines)과 유사한 안트라센 (anthracene)에서 유래 된 화합물로, DNA의 인터 칼 레이션 (intercalation)에 의한 토포 아이소 머라 제 II의 활성에 영향을 미친다. 그들은 전이성 유방암, 비호 지킨 림프종 (NHL) 및 백혈병에 사용됩니다.
이러한 약물은 일부 곤충, 식물 (frángula, senna, 대황), 지의 및 진균류의 안료에서 발견되었습니다. 뿐만 아니라 천연 미네랄 인 hoelita에서도 볼 수 있습니다. 그들의 복용량에 따라, 그들은 발암 성일 수 있습니다.
이 화합물들 중에 우리는 mitoxantrone과 그 유사 물질 인 losoxantrone을 가지고 있습니다. 이들은 악성 종양 세포의 증식을 막아 DNA에 비가 역적으로 결합합니다.
에피 독시 독소
epidofilotoxins (VP-16) 및 teniposide (VM-26)와 같은 Podophyllotoxins은 topoisomerase II와 복합체를 형성합니다. 폐, 고환, 백혈병, 림프종, 난소 암, 유방암 및 악성 두개 내 종양 등의 암에 사용됩니다. 그들은 식물에서 격리되어있다. Podophyllum notatum 및 P. peltatum.
캄토 테신 유사체
캄포 테 신은 토포 아이소 머라 제 I을 억제하는 화합물이며,이 중에서도 이리노테칸, 토포 테칸 및 디프로 모테 칸이있다.
이 화합물은 대장, 폐 및 유방암에 사용되어 왔으며, 교목 종의 나무 껍질과 잎에서 자연적으로 얻어진다 캄포 테카 아크 마타 복숭아와 티벳의.
자연 억제
토포 아이소 머라 제 I 및 II의 구조적 변형은 또한 완전히 자연적으로 발생할 수있다. 이것은 촉매 과정에 영향을주는 몇몇 사건들 동안 일어날 수있다..
이러한 변화 중에서 우리는 피리 미딘 다이머의 형성, 질소 염기의 불일치 및 산화 스트레스에 의한 다른 현상을 언급 할 수있다.
참고 문헌
- Anderson, H., & Roberge, M. (1992). DNA topoisomerase II : 염색체 구조, DNA 복제, 전사 및 유사 분열에 대한 관련성을 검토. Cell Biology International Reports, 16 (8) : 717-724. doi : 10.1016 / s0309-1651 (05) 80016-5
- Chhatriwala, H., Jafri, N., & Salgia, R. (2006). 폐암의 topoisomerase 억제에 대한 고찰. Cancer Biology & Therapy, 5 (12) : 1600-1607. doi : 10.4161 / cbt.5.12.3546
- Ho, Y.-P., Au-Yeung, S.C.F. 및 To, K.K.W. (2003). 백금 기반 항암제 : 혁신적인 디자인 전략 및 생물학적 관점. Medicinal Research Reviews, 23 (5) : 633-655. doi : 10.1002 / med.10038
- Li, T.-K., & Liu, L.F. (2001). topoisomerase-targeting drug에 의해 유발 된 종양 세포 죽음. Annual Review of Pharmacology and Toxicology, 41 (1) : 53-77. doi : 10.1146 / annurev.pharmtox.41.1.53
- Liu, L.F. (1994). DNA Topoisomerases : Topoisomerase-Targeting Drugs. 학술 보도 자료. pp 307
- Osheroff, N. 및 Bjornsti, M. (2001). DNA Topoisomerase. 효소학 및 약물. 제 2 권. Humana Press. pp 329.
- Rothenberg, M.L. (1997). Topoisomerase I inhibitors : 검토 및 업데이트. Annals of Oncology, 8 (9), 837-855. doi : 10.1023 / a : 1008270717294
- Ryan B. (2009, 12 월 14 일). Topoisomerase 1과 2. [비디오 파일]. youtube.com에서 가져옴


