히스 토나 스 특성, 구조, 유형 및 기능
그 히스톤 염색체를 구성하는 염색질 가닥을 구성하는 뉴 클레오 솜의 형성을 위해 DNA와 상호 작용하는 염기성 단백질이다..
DNA와 단백질에 의해 형성된 복합체 인 뉴 클레오 솜 (nucleosomes)은 1974 년에 발견되었으며이 염색질 조직의 기본 수준을 모으는 히스톤이다. 그러나 히스톤 단백질의 존재는 1960 년대 이전부터 알려져있다..
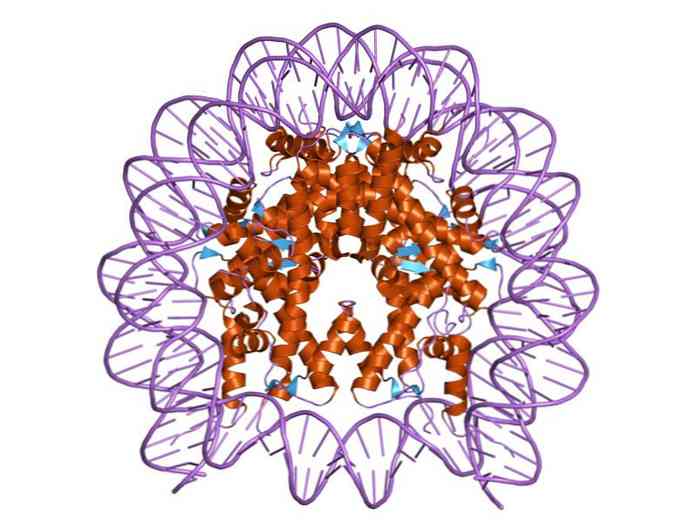
히스톤은 DNA 이중 밴드가 서로 밀접하게 상호 작용하는 이들 단백질로 구성된 단백질 센터를 감싸는 방식으로 구성되어 있습니다. 히스톤 중심은 디스크 모양을 가지고 DNA는 그 주위에 약 1.7 턴.
다중 수소 결합은 각 뉴 소솜의 히스톤에 의해 형성된 단백질 중심에 DNA가 결합되도록합니다. 이 결합은 대부분 히스톤의 아미노산 골격과 DNA의 당 - 인산 골격 사이에 형성됩니다. 일부 소수성 상호 작용 및 이온 결합도 참여.
"염색질 개질 복합체 (chromatin remodeling complexes)"로 알려진 단백질은 DNA와 히스톤 사이의 결합 결합의 파괴와 형성을 담당하여 뉴 클레오 솜 (nucleosomes)에 포함 된 DNA에 전사 기계가 들어갈 수있게합니다.
히스톤 단백질로 이루어진 코어로 핵산의 가까움에도 불구하고, 이들은 필요에 따라 전사 인자 및 기타 발현 유전자 침묵 또는 관련 단백질의 진입을 허용 그래서, 배치되고.
히스톤은 다양한 변형을 일으켜 다양한 방법으로 유전자 발현을 조절할 수있는 많은 다른 형태의 염색질의 존재를 가능하게한다.
색인
- 1 특성
- 2 구조
- 2.1 유니온 히스톤
- 3 가지 유형
- 3.1 뉴 클레오 솜 히스톤
- 3.2 유니온 히스톤
- 4 함수
- 5 참고
특징
그들은 자연에서 가장 보존 된 진핵 생물 단백질입니다. 예를 들어, 완두콩 히스톤 H4가 소 단백질 H4의 102 아미노산 위치 중 단지 2 개에서 상이하다는 것이 밝혀졌습니다.
히스톤은 상대적으로 작은 단백질로 140 개 이상의 아미노산을 가지고 있습니다. 그것들은 염기성 아미노산 잔기가 풍부하여 양전하를 띄며, 음전하를 띤 핵산과의 상호 작용에 기여하여 뉴 클레오 솜을 형성한다.
Nucleosomal and junctional 또는 bridged histones이 알려져 있습니다. 뉴 클레오 솜 히스톤은 H3, H4, H2A 및 H2B이며, 결합 히스톤은 H1 히스톤 패밀리에 속한다.
뉴 클레오 솜의 조립 동안, 특정 이량 체 H3-H4 및 H2A-H2B가 처음에 형성된다. 이어서, 2 개의 H3-H4 이합체가 합쳐져 사량 체를 형성하고,이어서 H2A-H2B 이합체와 결합하여 8 량체 중심을 형성한다.
모든 히스톤은 주로 세포주기의 S기에 합성되며 뉴 클레오 솜은 복제 포크 직후에 초기 DNA 나선으로 모입니다..
구조
히스톤의 일반적인 구조는 진핵 생물들 사이에서 염기성 아미노산 영역 및 고도로 보존 된 구형 카복실 영역을 포함한다.
"히스톤 스크롤"로 알려진 구조적 모티브 세 개의 알파 나선 및 작은 소수성 중심부를 형성하는 요크로 연결된 두 개의 구성의 뉴 클레오 히스톤 형성 간의 단백질 - 단백질 상호 작용에 대한 책임.
모든 진핵 생물에서 상기 뉴 클레오 솜 단백질의 구형 카르 복실 도메인을 구성하는 것은 히스톤의이 폴드이다.
히스톤은 길이가 40 아미노산 이하인 작은 "꼬리 (tail)"또는 아미노 말단과 다른 카르 복실 말단 영역 (프로테아제에 접근 가능)을 가지고있다. 두 지역 모두 여러 개의 번역 후 공유 결합 변형을 거칠 수있는 염기성 아미노산이 풍부합니다.
유니온 히스톤
진핵 생물에는 노조의 히스톤 (histones)의 두 가지 계열이 있으며, 이들의 구조에 따라 구분됩니다. 일부는 N 형과 C 형의 "구조화되지 않은"도메인이있는 위에서 묘사 된 구형 도메인을 가진 삼자 구조를 가지고있다. 다른 것들은 단지 C- 말단 영역만을 갖는다.
대부분의 히스톤이 보존되어 있지만 일부 배아는 일부 유기체에서 배아 발생이나 특수 세포의 성숙 과정에서 발생할 수 있습니다. 구조적 변형은 다음과 같은 번역 후 변형과 관련이 있습니다.
-인산화: 염색질의 응축 정도가 수정 된 것으로 생각되며 일반적으로 세린 잔기에서 발견됩니다.
-아세틸 화: transcriptionally active 인 염색체 부위와 관련있다. 그것은 일반적으로 라이신 잔기의 측쇄에서 발생합니다. 이러한 잔기에서 발생하면 양전하가 감소하여 단백질과 DNA의 친 화성이 감소합니다.
-메틸화: 단백질 중핵에서 튀어 나오는 라이신 잔기의 mono-, di- 또는 tri- metilación으로 주어질 수있다.
특정 효소는 히스톤에서 이러한 공유 결합 변형을 일으킨다. 이러한 효소에는 히스톤 아세틸 트랜스퍼 라 아제 (HAT), 히스톤 - 탈 아세틸 화 효소 복합체 (HDAC), 히스톤 - 메틸 전이 효소 및 데 메틸 화 효소가 포함됩니다..
유형
히스톤의 특성 분석은 다양한 생화학 기술에 의해 수행되었으며, 그 중 약한 양이온 교환 수지를 기반으로하는 크로마토 그래피가 두드러졌습니다.
일부 저자는 진핵 생물에서 5 가지 주요 유형의 히스톤이 구별되는 분류 방법을 확립한다 : FI, 21kDa 단백질; 플러스 또는 마이너스 11.3 kDa의 F2A1 또는 FIV; F2A2 또는 FIIbI, 14.5 kDa; F2B 또는 FIIb2, 13.7 kDa의 분자량 및 15.3 kDa의 F3 또는 FIII.
FI 그룹을 제외한 모든 유형의 히스톤은 세포에서 등 몰량으로 발견됩니다.
같은 힘과 아마도 가장 오늘날 사용되는 또 다른 분류는, 사이의 뉴 클레오을 연결하는, 즉 히스톤의 두 가지 유형, 뉴 클레오의 옥타의 일부 히스톤 바인딩 또는 브리지있는 것들의 존재를 제안한다 예.
또한 종 사이 코어 히스톤 달리 발생할 수있는 변형, 변형 간기 동안 합성과 ATP 가수 분해로부터 방출되는 에너지에 의존하는 방법으로 예비 성형 염색질에 삽입.
핵산 히스톤
nucleosome의 핵은 4 개의 구성 성 histones 각각의 한 쌍으로 이루어져있다 : H2a, H2b, H3 및 H4; 약 145 염기 쌍의 DNA 분절이 감싸 이는.
히스톤 H4와 H2B는 원칙적으로 변하지 않습니다. 그러나 히스톤 H3과 H2A에서 일부 변이가 분명하며, 생물 물리학 적 특성과 생화학 적 특성이 뉴 소 솜의 정상적인 특성을 변화시킨다.
인간의 히스톤 H2A의 변형 인 H2A.Z 단백질은 큰 산성 영역을 가지고 있으며 관련된 히스톤 H3 변이체에 따라 nucleosome의 안정성을 선호 할 수 있습니다.
이 히스톤은 종간의 변이를 보여 주며, 히스톤 H2B의 특별한 경우인데, 분자의 1/3이 매우 가변적이다.
유니온 히스톤
접합부 또는 교량 히스톤은 H1 등급의 히스톤이다. 이것들은 뉴 클레오 솜과 각 입자의 시작과 끝 부분에서 튀어 나온 DNA 보호 사이의 연합을 담당합니다.
뉴 클레오 솜 히스톤과는 달리, H1 유형의 모든 히스톤이 히스톤의 "fold"의 구형 영역을 갖는 것은 아닙니다. 이 단백질은 뉴 클레오 솜 사이의 DNA에 결합하여 염색질의 균형이보다 응축되고 덜 활성 인 상태로 변화되도록 촉진하며 전사적으로 말함.
연구들은 이러한 histone과 노화, DNA 수리 및 apoptosis 과정을 연관 시키므로 genomic integrity의 유지에 결정적인 역할을한다고 여겨진다.
기능들
히스톤의 모든 아미노산 잔기는 DNA와의 상호 작용에 어떤 방식 으로든 참여하며, 이는 진핵 생물의 왕국간에 보존되어 있다는 사실을 설명한다.
염색질의 형태로 DNA 포장에서 히스톤의 참여는 다른 세포 계보 그냥 전사 기계에 자신의 유전자의 접근성을 변화 전문 수있는 복잡한 다세포 생물에 매우 관련이.
전사 활성 게놈 영역은 뉴 클레오 솜이 고밀도이기 때문에 DNA의 히스톤 단백질과의 결합이 전사의 음성 또는 양성 조절에 결정적인 역할을한다는 것을 시사한다.
마찬가지로, 내부 및 외부의 다양한 자극에 대한 세포의 반응의 수명이 다할 때까지, 보통에서 발견 히스톤의 리모델링 및 전사 후 수정하고 관계 염색질의 작은 변화에 따라 달라집니다 DNA와의 밀접한 관계.
다중 히스톤 변수는 진핵 생물에서 다른 기능을 발휘합니다. 그들 중 하나는 유사 분열 동안 염색체의 분리를 담당하는 동력 학적 구조의 형성에 히스톤 H3 변이종의 참여와 관련이있다.
다른 진핵 생물에서이 단백질의 대응 물은 유사 분열 및 감수 분열 동안 스핀들 미세 소관이 결합하는 단백질 키네 토코 어 (kinetochore)의 조립에 필수적이라는 것이 밝혀졌습니다..
참고 문헌
- Alberts, B., Johnson, A., Lewis, J., Morgan, D., Raff, M., Roberts, K., Walter, P. (2015). 세포의 분자 생물학 (제 6 에디션). 뉴욕 : 갈랜드 과학.
- Campos, E.I. & Reinberg, D. (2009). 히스톤 : 염색체 주석 달기. 아누. Genet., 43, 559-599.
- Harvey, A. C., & Downs, J. A. (2004). 링커 히스톤이 제공하는 기능은 무엇입니까? Molecular Microbiology, 53, 771-775.
- Henikoff, S., & Ahmad, K. (2005). 변이 형 히스톤의 염색질로의 조립. 아누. 셀. Dev. Biol., 21, 133-153.
- Isenberg, I. (1979). 히스톤 스. 아누. Rev. Biochem., 48, 159-191.
- Kornberg, R.D., & Thomas, J.O. (1974). Chromatin 구조 : Histones의 Oligomers. Science, 184 (4139), 865-868.
- Smith, E., DeLange, R., & Bonner, J. (1970). Histones의 화학과 생물학. 생리학 리뷰, 50 (2), 159-170.


