케톤 생성물의 케톤 생성 유형, 합성 및 분해
그 케톤 생성 아세토 아세테이트, 베타 - 하이드 록시 부티레이트 및 아세톤이 얻어지며,이를 함께 케톤 바디 (ketone bodies)라고 부른다. 이 복잡하고 정밀하게 조절 된 메커니즘은 미토콘드리아에서, 지방산의 이화 작용.
케톤체의 획득은 유기체가 철저한 금식 기간을 거칠 때 이루어진다. 이 대사 산물은 간 세포에서 주로 합성되지만 골격근과 심장 및 뇌 조직과 같은 다양한 조직에서 중요한 에너지 원으로 밝혀졌습니다..
Β- 하이드 록시 부티레이트 및 아세토 아세테이트는 심장 근육 및 신장 피질의 기질로 사용되는 대사 산물입니다. 두뇌에서 케톤 신체는 신체가 포도당 예비를 소진했을 때 중요한 에너지 원이됩니다.
색인
- 1 일반적인 특성
- 케톤 바디의 종류와 성질
- 케톤 시약의 합성
- 3.1 케톤 생성의 조건
- 3.2 메커니즘
- 3.3 β- 산화와 케톤 생성은 관련이있다.
- 3.4 β 산화의 조절 및 케톤 생성에 대한 그 효과
- 4 저하
- 5 케톤 시체의 의학적 타당성
- 5.1 당뇨병과 케톤체 축적
- 6 참고 문헌
일반적인 특성
Ketogenesis는 매우 중요한 생리 기능 또는 대사 경로로 간주됩니다. 일반적으로이 메커니즘은 간에서 수행되지만 지방산을 대사 할 수있는 다른 조직에서 수행 될 수 있음이 밝혀졌습니다.
케톤 시체의 형성은 아세틸 -CoA의 주요 대사 산물이다. 이 대사 산물은 지방산의 분해 인 베타 산화 (beta-oxidation)로 알려진 대사 과정에서 얻어집니다.
β- 산화가 일어나는 조직에서 포도당의 이용 가능성은 아세틸 -CoA의 대사 과정을 결정합니다. 특정 상황에서 산화 된 지방산은 케톤 바디의 합성에 거의 전적으로 의존합니다.
케톤 바디의 종류와 성질
주 케톤 몸체는 주로 아세토 아세테이트 또는 아세토 아세트산이며, 이는 주로 간세포에서 합성됩니다. 케톤 바디를 구성하는 다른 분자는 아세토 아세테이트.
아세토 아세트산의 환원은 두 번째 케톤 체인 D-β-hydroxybutyrate를 발생시킨다. 아세톤은 분해하기 어려운 화합물이며, 아세토 아세테이트의 탈 카복실 반응 (즉, 어떤 효소의 개입을 필요로하지 않음)의 자발적 반응에 의해 생성되며, 혈액에 고농도로 존재할 때 발생합니다.
엄격히 말하면 β- 하이드 록시 부티레이트는 케톤 작용을 갖지 않기 때문에, 케톤 바디의 지정은 협약에 의해 정해져있다. 이 세 분자는 물에 용해되어 혈액 내 수송을 촉진합니다. 주요 기능은 골격 및 심장 근육과 같은 특정 조직에 에너지를 공급하는 것입니다.
케톤체 형성에 관여하는 효소는 주로 간과 신장 세포에 존재하는데,이 두 위치가 왜 이들 대사 산물의 주요 생성 원인인지를 설명합니다. 그것의 합성은 오직 세포의 미토콘드리아 기질에서만 일어난다..
일단 이들 분자가 합성되면 혈류로 들어가서 필요한 조직으로 이동하여 아세틸 -CoA로 분해됩니다.
케톤 시약의 합성
케톤 생성의 조건
β 산화에 의한 acetyl-CoA의 대사 과정은 유기체의 대사 요구 사항에 달려있다. 이것은 CO로 산화된다.2 및 H2또는 구연산 순환 또는 지방산의 합성을 통해 지질과 탄수화물의 신진 대사가 신체에서 안정적이라면.
시체가 탄수화물의 형성을 필요로 할 때, 구연산 순환을 시작하는 대신에 옥 살로 아세테이트 (oxaloacetate)가 포도당 (포도당 생성)을 생산하는 데 사용됩니다. 앞서 언급했듯이 장기간의 금식이나 당뇨병과 같은 경우에는 신체가 포도당을 섭취 할 수 없을 때 발생합니다..
이로 인해 지방산의 산화로 인해 생성 된 아세틸 -CoA는 케톤 바디의 생산에 사용됩니다.
메커니즘
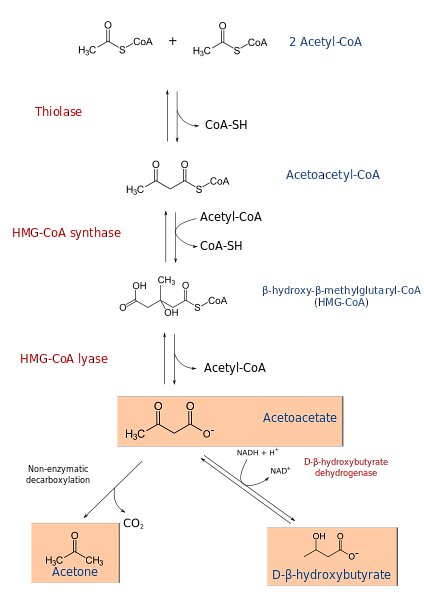
케톤 생성의 과정은 β- 산화 생성물 인 아세트 아세틸 -CoA 또는 아세틸 -CoA로부터 출발한다. 기질이 아세틸 -CoA 인 경우, 제 1 단계는 아세틸 -CoA 트랜스퍼 라제에 의해 촉매 화되는 반응 인 2 분자의 축합을 포함하여 아세틸 아세틸 -CoA.
아세트 아세틸 -CoA는 HMG-CoA 신타 제의 작용에 의해 제 3의 아세틸 -CoA와 축합되어 HMG-CoA (β- 하이드 록시 -β- 메틸 글 루타 릴 -CoA)를 생성한다. HMG-CoA는 HMG-CoA 리아제의 작용에 의해 아세토 아세테이트 및 아세틸 -CoA로 분해된다. 이러한 방식으로, 제 1 케톤체가 수득된다.
아세토 아세테이트는 β- 하이드 록시 부티레이트 탈수소 효소의 개입에 의해 β- 하이드 록시 부티레이트로 환원된다. 이 반응은 NADH에 달려있다..
주 아세토 아세테이트 케톤 몸체는 비 효소 탈 카복실 화 반응을 거치는 β- 케 토산이다. 이 공정은 간단하며 아세톤과 CO를 생성합니다.2.
따라서 이러한 일련의 반응은 케톤 시체를 발생시킵니다. 이들은 수용성 매체에 불용성 인 지방산의 경우와 같이 알부민 구조에 앵커 할 필요없이 혈류를 통해 쉽게 전달 될 수 있습니다.
Β- 산화와 케톤 생성은 관련이있다.
지방산의 대사는 케톤 생성에 대한 기질을 생산하므로이 두 경로는 기능적으로 관련이 있습니다.
Acetoacetyl-CoA는 β- 산화의 첫 번째 효소 인 acyl-CoA dehydrogenase의 활성을 정지시키기 때문에 지방산 대사의 억제제이다. 또한, 아세틸 -CoA 트랜스퍼 라제 및 HMG-CoA 신타 제를 저해한다.
CPT-1 (β- 산화에서 아실 카르니틴의 생산에 관여하는 효소)에 종속되는 HMG-CoA 신타 제 효소는 지방산 형성에 중요한 조절 역할을 나타낸다.
β- 산화 조절 및 케톤 생성에 미치는 영향
유기체의 먹이는 복잡한 일련의 호르몬 신호를 조절합니다. 식이 요법에서 섭취되는 탄수화물, 아미노산 및 지질은 지방 조직에 트리 아실 글리세롤의 형태로 축적됩니다. 단백 동화 호르몬 인 인슐린은 지질의 합성과 트리 아실 글리세롤의 형성에 관여한다.
미토콘드리아 수준에서 β 산화는 미토콘드리아에 일부 기질이 들어가고 참여함으로써 제어됩니다. CPT I 효소는 세포질 아실 CoA로부터 아실 카르니틴을 합성한다.
유기체가 공급되면 acetyl-CoA carboxylase가 활성화되고 citrate는 CPT I의 수준을 증가 시키지만 인산화는 감소합니다 (cyclic AMP-dependent reaction).
이것은 말로 닐 CoA의 축적을 유발하여 지방산의 합성을 자극하고 산화를 차단하여 무의미한 순환이 생성되는 것을 방지합니다.
공복시의 경우, CPT I 효소의 수준이 감소되어 지질의 산화를 활성화하고 활성화 시키며 인산화되어 이후 케톤체 형성을 가능하게하므로 카르 복실 라제의 활성이 매우 낮습니다 아세틸 -CoA.
저하
케톤 (Ketone) 몸체는 세포 밖으로 확산되어 혈류에 의해 말초 조직으로 전달되고 운반됩니다. 이 조직에서 트리 카르 복실 산 사이클을 통해 산화 될 수 있습니다.
말초 조직에서 베타 - 하이드 록시 부티레이트는 아세토 아세테이트로 산화된다. 이어서, 본 아세토 아세테이트는 효소 3- 케 토아 실 -CoA 트랜스퍼 라제.
석시 닐 -CoA는 숙신산이되는 CoA 기증자로서 작용한다. acetoacetate의 활성화는 succinyl-CoA syntactase의 작용에 의한 GTP의 결합 된 합성과 함께 구연산 사이클에서 숙시 닐 -CoA가 석시 케이트 화되는 것을 방지하기 위해 일어난다.
생성 된 아세토 아세틸 -CoA는 트리 크레타 산 사이클에 혼입 된 2 개의 아세틸 -CoA 분자를 생성하는 티올 라이트 절단을 거치며, 이는 크렙스 사이클 (Krebs cycle)로 잘 알려져있다..
간 세포에는 3- 케 토아 실 -CoA 트랜스퍼 라제가 부족하여이 대사 산물이 이들 세포에서 활성화되는 것을 방지합니다. 이런 식으로 케톤체는 생산 된 세포에서 산화되지 않지만 세포의 활동이 요구되는 조직으로 옮겨 질 수 있음을 보장합니다..
케톤 시체의 의료 관련성
인체에서는 혈액 속의 고농축 케톤체가 산성 증 및 케톤 혈증이라는 특수한 상태를 유발할 수 있습니다.
이 대사 산물의 생산은 지방산과 탄수화물의 이화 작용에 해당합니다. 병적 인 케톤 생성 상태의 가장 일반적인 원인 중 하나는 트리 카르 복실 산 산화 경로에 의해 분해되지 않는 아세트산 디카 르보 네이트 조각의 고농도이다..
결과적으로 2 ~ 4 mg / 100 N 이상의 혈액에서 케톤 체의 수준이 증가하고 소변에서 이들의 존재가 증가합니다. 이것은 상기 대사 물의 중간 대사를 교란시킨다.
탄수화물의 대사 장애와 함께 케톤 체의 분해 및 합성을 조절하는 신경 세포 뇌하수체 인자의 특정 결점은 과다 결핍 상태의 원인이된다.
당뇨병과 케톤체 축적
당뇨병 (유형 1)은 케톤 (ketone) 몸체의 생산을 증가시키는 내분비 질환입니다. 부적절한 인슐린 생산으로 인해 포도당이 근육, 간 및 지방 조직으로 이동되어 혈액에 축적됩니다.
글루코오스가없는 세포는 글루코 네오 신 (gluconeogenesis)과 지방과 단백질 분해 과정을 시작하여 신진 대사를 회복시킵니다. 결과적으로, 옥살로 아세테이트 농도가 감소하고 지질 산화가 증가한다.
그러면 oxaloacetate가없는 상태에서 구연산 경로를 따라갈 수없는 acetyl-CoA가 축적되어이 질환의 특징 인 케톤 생성을 촉진시킵니다.
아세톤의 축적은 소변에서의 존재와이 상태를 가진 사람들의 호흡에 의해 감지되며 사실이 질병의 징후를 나타내는 증상 중 하나입니다.
참고 문헌
- Blázquez Ortiz, C. (2004). 성상 세포에서의 Ketogenesis : 특성화, 조절 및 가능한 세포 보호제 역할 (박사 학위 논문, Universidad Complutense de Madrid, 출판 서비스).
- Devlin, T.M. (1992). 생화학 교재 : 임상 상관 관계.
- Garrett, R.H., & Grisham, C.M. (2008). 생화학. 톰슨 브룩스 / 콜.
- McGarry, J.D., Mannaerts, G.P. & Foster, D.W. (1977). 간 지방산 산화 및 케톤 생성의 조절에서 말로 닐 -CoA에 대한 가능한 역할. 임상 연구 저널, 60(1), 265-270.
- Melo, V., Ruiz, V. M., & Cuamatzi, O. (2007). 대사 과정의 생화학. 되돌리기.
- Nelson, D.L., Lehninger, A.L., & Cox, M.M. (2008). 생화학 원리. 맥밀런.
- Pertierra, A.G., Gutiererz, C.V., & Others, C.M. (2000). 대사 생화학의 기초. Editorial Tébar.
- Voet, D., & Voet, J. G. (2006). 생화학. 에드 파나 메리 카나 메디컬.


