화학 방정식의 균형 조정 방법 및 예
그 화학 방정식의 균형 상기 방정식에 존재하는 모든 원소는 각면에 동일한 수의 원자를 갖는다는 것을 의미한다. 이를 달성하기 위해서는 반응에 존재하는 각 화학 종에 적합한 화학량 론 계수를 할당하기 위해 균형 방법을 사용할 필요가 있습니다.
화학 방정식은 두 개 이상의 물질 사이의 화학 반응 과정에서 일어나는 일을 상징으로 표현한 것입니다. 반응물은 서로 상호 작용하며, 반응 조건에 따라, 하나 이상의 상이한 화합물이 생성물로서 수득 될 것이다..
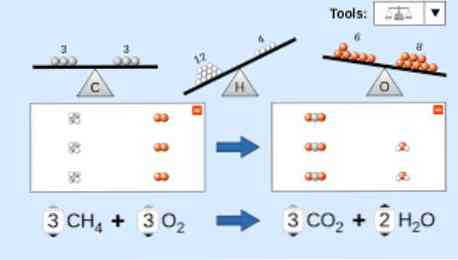
화학 반응식을 설명 할 때 다음 사항을 고려해야합니다. 첫째, 반응 물질은 반응의 유형에 따라 방정식의 왼쪽에 쓰여지고 단방향 화살표 또는 반대쪽에 두 개의 수평 화살표가 뒤 따릅니다. 망토.
색인
- 1 화학 방정식을 균형 잡는 방법
- 1.1 시행 착오에 의한 화학 방정식의 균형 (검사 또는 시험이라고도 함)
- 1.2 화학 방정식의 대수 균형
- 1.3 산화 환원 방정식의 롤링 (이온 전자 방법)
- 2 균형 화학 방정식의 예
- 2.1 첫 번째 예
- 2.2 두 번째 예제
- 2.3 세 번째 예
- 3 참고
화학 방정식의 균형 방법
반응물과 생성물이 알려져 있고, 반응물과 생성물이 알려져 있고, 반응식과 반응식이 일치하는 측면에서 반응식이 정확하게 표현된다는 근거를 토대로, 다음의 방법에 따라 반응식의 균형을 맞춘다.
시행 착오에 의한 화학 방정식의 균형 (검사 또는 시험이라고도 함)
그것은 반응의 화학 양롞에 근거하고 방정식의 균형을 맞추기 위해 서로 다른 계수를 시도하려고합니다. 가능한 한 작은 정수가 선택되어 각 요소의 동일한 원자 갯수가 양쪽에서 얻어지는 한 반응의.
반응물 또는 생성물의 계수는 수식에 앞선 수이며, 수식의 첨자를 변경하면 화합물의 신원이 바뀌므로 수식의 균형을 맞출 때 변경할 수있는 유일한 숫자입니다 문제의.
집계 및 비교
반응의 각 요소를 확인하고이를 올바른면에 놓은 후에 우리는 방정식에있는 각 원소의 원자 수를 계산하고 비교하여 균형을 잡아야하는 요소를 결정합니다.
그런 다음 각 요소의 균형을 유지하면서 (한 번에 하나씩) 불균형 요소가 포함 된 각 수식 앞에 전체 계수를 배치합니다. 일반적으로 금속 원소는 먼저 균형을 이루고, 비금속 원소와 마지막으로 산소와 수소 원자가 균형을 이룬다..
이 방법으로 각 계수는 앞의 공식의 모든 원자를 곱합니다. 그래서 요소의 균형을 잡는 동안 다른 요소들은 불균형을 일으킬 수 있지만, 이것은 반응이 균형을 이루면 해결됩니다..
마지막으로, 방정식 전체가 정확하게 균형을 이룬다는 마지막 계수에 의해 뒷받침됩니다. 즉, 물질 보존 법칙을 준수한다는 것입니다.
화학 방정식의 대수 균형
이 방법을 사용하기 위해서는 화학 방정식의 계수를 해결해야하는 시스템의 미지수로 취급하는 절차가 수립됩니다..
먼저 반응의 특정 원소를 기준으로 취하고 계수는 각 분자의 원소의 기존 원자에 따라 미지수를 나타내는 문자 (a, b, c, d ...)로 배치됩니다 (if 그 종을 포함하고 있지 않은 종은 "0"이라고 표시됨).
이 첫 번째 방정식을 얻은 후, 반응에 존재하는 다른 원소에 대한 방정식이 결정됩니다. 상기 반응에 요소가있는만큼 많은 방정식이있을 것이다..
마지막으로, 미지수는 감소, 균등화 또는 대체의 대수적 방법 중 하나에 의해 결정되며 계수가 얻어 져서 정확하게 균형 잡힌 방정식이됩니다.
균형을 이루는 산화 환원 방정식 (이온 전자 방법)
먼저 일반적인 (불균형) 반응은 이온 형태로 놓인다. 다음이 방정식은 산화와 환원의 두 반 반작용으로 나누어지며 원자 수, 유형 및 이들의 투입량에 따라 균형을 이룹니다..
예를 들어, 산성 매질에서 일어나는 반응에 대해, H 분자가 첨가된다.2또는 산소 원자의 균형을 맞추고 H+ 수소 원자의 균형을 맞추기.
대조적으로, 알칼리성 매질에서 동일한 수의 OH 이온이 첨가된다- 각 H 이온에 대한 방정식의 양면에+, H 이온이 발생하는 곳+ 및 OH- 그들은 함께 H 분자를 형성한다.2O.
전자 추가
그런 다음 각 반 반응에서 물질의 균형을 잡은 후에 전하의 균형을 맞추는 데 필요한만큼 전자를 추가해야합니다.
각 반 반응의 롤링에 이어 최종 시험을 시행 착오의 균형을 맞추어 더합니다. 2 개의 하프 - 반응의 전자 수의 차이가있는 경우, 하나 또는 둘 모두에이 수와 동일한 계수를 곱해야한다.
마지막으로, 방정식은 동일한 방정식의 원자와 동등한 유형의 원자를 포함하며, 방정식의 양 측면에 동일한 전하를 가짐을 입증해야한다.
균형 화학 방정식의 예
첫 번째 예
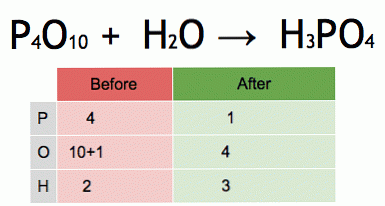
이것은 균형 잡힌 화학 반응식의 애니메이션입니다. 오산화 인과 물은 인산.
P4O10 + 6H2O → 4H3PO4 (-177kJ).
두 번째 예
에탄의 연소 반응 (불균형).
C2H6 + O2 → CO2 + H2O
시행 착오의 방법을 사용하여 균형을 잡을 때, 요소 중 어느 것도 방정식의 양쪽에 같은 원자 수를 갖지 않는다는 것이 관찰됩니다. 따라서 탄소 균형으로 시작하여 제품 측면에서 2를 화학량 론적 계수로 추가합니다.
C2H6 + O2 → 2CO2 + H2O
탄소는 양쪽에서 균형을 이루었으므로 물 분자에 3을 더하여 수소의 균형을 맞 춥니 다..
C2H6 + O2 → 2CO2 + 3H2O
마지막으로, 방정식의 오른쪽에 7 개의 산소 원자가 있고 균형을 유지해야하는 마지막 요소이기 때문에 분수 7/2가 산소 분자 앞에 배치됩니다 (전체 계수가 일반적으로 선호 되기는하지만).
C2H6 + 7 / 2O2 → 2CO2 + 3H2O
그런 다음 방정식의 각면에 동일한 수의 탄소 원자 (2), 수소 (6) 및 산소 (7)가 있는지 확인하십시오..
세 번째 예제
중크롬산 이온에 의한 철의 산화는 산성 매질 (불균형 및 이온 성 형태).
신앙2+ + 크롬2O72- → 신앙3+ + 크롬3+
그것의 균형 잡기를 위해 이온 전자 방법을 사용하여, 그것은 두 개의 반 반응.
산화 : 신앙2+ → 신앙3+
감소 : Cr2O72- → Cr3+
철 원자가 이미 균형을 이루고 있기 때문에 (1 : 1), 전자가 제품 측면에 추가되어 전하의 균형을 맞 춥니 다..
신앙2+ → 신앙3+ + 전자-
이제 Cr의 원자가 균형을 이루며 방정식의 오른쪽에 2가 추가됩니다. 그런 다음, 반응이 산성 매질에서 일어날 때, 7 개의 H 분자가 첨가된다.2또는 제품 측면에서 산소 원자의 균형을 맞추십시오..
크롬2O72- → 2Cr3+ + 7H2O
H 원자들의 균형을 맞추기 위해, 14 개의 H 이온이 첨가된다+ 반응물의 측면에서, 그리고 물질을 균등화시킨 후에, 전하가 동일한 측상의 6 개의 전자의 첨가에 의해 균형 잡힌다.
크롬2O72- +14H+ + 6e- → 2Cr3+ + 7H2O
마지막으로 두 반쪽 반응이 추가되지만 산화 반응에 전자가 하나만 있기 때문에이 모두에 6을 곱해야합니다.
6 번2+ + 크롬2O72- +14H+ + 6e- → 신앙3+ + 2Cr3+ + 7H2O + 6e-
마지막으로 전자는 전지구 이온 방정식의 양면에서 제거되어야하며, 이들의 전하와 물질이 정확하게 균형을 이룬다는 것을 증명해야한다.
참고 문헌
- Chang, R. (2007). 화학 (9th ed). 맥그로 힐.
- Hein, M., and Arena, S. (2010). 대학 화학의 기초, 대체. books.google.co.ve에서 가져옴
- Tuli, G. D. 및 Soni, P. L. (2016). 화학 또는 화학 방정식의 언어. books.google.co.ve에서 가져옴
- 신속한 출판 (2015). 화학 방정식과 답 (빠른 연구 가이드). books.google.co.ve에서 가져옴


