환경 화학 분야의 연구 및 응용 분야
그 환경 화학 그것은 환경 적 차원에서 일어나는 화학적 과정을 연구합니다. 환경 성과 및 인간 활동에 의해 생성 된 영향 연구에 화학 원리를 적용하는 과학입니다..
또한 환경 화학은 기존 환경 손상에 대한 방지, 완화 및 개선 기술을 설계합니다..
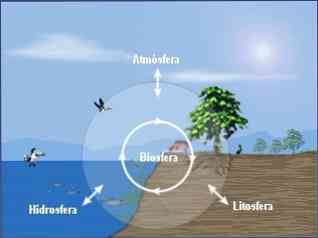
환경 화학은 세 가지 기본 분야로 세분 될 수 있습니다 :
- 대기의 환경 화학.
- 수권의 환경 화학.
- 환경 토양 화학.
환경 화학에 대한 포괄적 인 접근법은이 세 구획 (대기, 수권, 토양)에서 발생하는 화학적 과정과 생물권과의 관계 사이의 상호 관계에 대한 연구도 필요로한다.
색인
- 1 대기의 환경 화학
- 1.1 - 성층권
- 1.2 - 대류권
- 2 수권의 환경 화학
- 2.1 - 담수
- 2.2 - 물주기
- 2.3 - 물주기에 대한 인류 학적 영향
- 3 환경 토양 화학
- 3.1 토양
- 3.2 토양에 대한 인류 학적 영향
- 4 화학 - 환경 관계
- 4.1 - 모델 Garrels와 Lerman
- 5 환경 화학 응용
- 6 참고 문헌
대기의 환경 화학
대기는 지구를 둘러싼 가스층입니다. 온도, 압력 및 화학 성분이 매우 넓은 범위에서 고도에 따라 변하는 매우 복잡한 시스템입니다.
태양은 방사선 및 고 에너지 입자로 대기를 폭격합니다. 이 사실은 대기의 모든 층에서 매우 중요한 화학적 영향을 미치지 만, 특히 최상층과 외층에서.
-성층권
광 해리 및 광 이온화 반응은 대기의 바깥 쪽 영역에서 발생합니다. 지구 표면에서 측정 한 높이가 30 ~ 90km 인 지역에서는 성층권에서 주로 오존을 포함하는 층이 위치한다 (또는3), 오존층.
오존층
오존은 태양으로부터 오는 고 에너지 자외선 복사를 흡수합니다.이 층이 존재하지 않는다면, 지구상에서 알려진 삶의 방식은 존재하지 않을 수 있습니다..
1995 년에 대기 화학자 인 Mario J. Molina (멕시코), Frank S. Rowland (미국) 및 Paul Crutzen (네덜란드)은 성층권에서 오존의 파괴와 고갈에 관한 연구로 노벨 화학상을 수상했습니다..
1970 년 Crutzen은 질소 산화물이 촉매 화학 반응을 통해 오존을 파괴한다는 것을 보여주었습니다. 이어서 Molina와 Rowland는 1974 년에 클로로 플루오로 카본 화합물 (CFC 's)의 염소가 오존층을 파괴 할 수 있음을 보여주었습니다.
-대 상
대류권이라 불리는 지표면 바로 위에있는 0 ~ 12km의 대기층은 주로 질소 (N2) 및 산소 (O2).
유독 가스
인간 활동의 결과로 대류권은 다음과 같이 대기 오염 물질로 간주되는 많은 추가 화학 물질을 포함합니다.
- 이산화탄소와 일산화탄소 (CO2 및 CO).
- 메탄 (CH4).
- 질소 산화물 (NO).
- 이산화황 (SO)2).
- 오존 오3 (대류권에서 오염 물질로 간주 됨)
- 휘발성 유기 화합물 (VOC), 분말 또는 고체 입자.
인간 및 식물과 동물의 건강에 영향을 미치는 많은 다른 물질들.
산성비
황산화물 (SO2 및 SO3) 및 질소 산화물 (예 : 아산화 질소 (NO2), 산성비라고하는 또 다른 환경 문제가 발생합니다.
대류권에서 주로 산업 활동과 수송에서 화석 연료의 연소 생성물로 존재하는이 산화물은 황산과 질산을 생산하는 빗물과 반응하여 결과적으로 산 침전을 일으킨다.
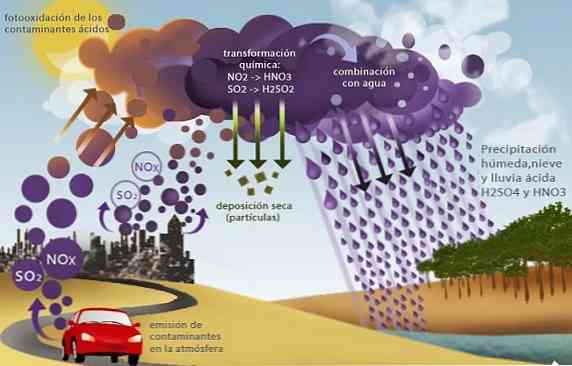
강산을 포함하고있는이 비를 침강시킴으로써 바다와 담수의 산성화와 같은 여러 가지 환경 문제를 유발합니다. 이것은 수생 생물의 죽음을 초래한다. 농작물의 죽음을 초래하는 토양의 산성화와 건물, 교량 및 기념물의 화학적 부식 작용에 의한 파괴.
다른 대기 환경 문제는 주로 질소 산화물과 대류권 오존에 의한 광화학 스모그이다
지구 온난화
지구 온난화는 고농축의 일산화탄소2 대기 및 기타 온실 가스 (GHGs)는 지구 표면에서 방출되는 적외선 복사의 대부분을 흡수하고 대류권에서 열을 가두어줍니다. 이것은 행성에 기후 변화를 일으킨다..
수권의 환경 화학
하이드로 페라는 지구의 모든 수역 (수면, 습지대, 대양, 호수, 강, 샘, 지하 또는 대수층)이 준수합니다..
-담수
물은 지구상에서 가장 보편적 인 액체 물질로 지구 표면의 75 %를 차지하며 삶에 절대적으로 필수적입니다.
모든 생명체는 담수 (0.01 % 미만의 염 함량을 갖는 물로 정의 됨)에 의존합니다. 행성의 물의 97 %가 바닷물입니다..
담수의 나머지 3 % 중 87 %는 다음과 같습니다.
- 지구의 기둥 (지구 온난화로 인해 녹고 바다로 쏟아지는).
- 빙하 (또한 사라지는 과정에서).
- 지하수.
- 대기 중에 존재하는 수증기 형태의 물.
지구 전체 담수의 0.4 %만이 소비가 가능합니다. 바다에서 물의 증발과 비의 강수량이 지속적으로 작은 비율을 제공합니다.
물의 환경 화학은 물 순환 또는 수문 순환에서 발생하는 화학 공정을 연구하고 인간 소비를위한 물 정화, 산업 및 도시 폐수 처리, 해수 담수화, 재활용 이 자원을 저장하는 것.
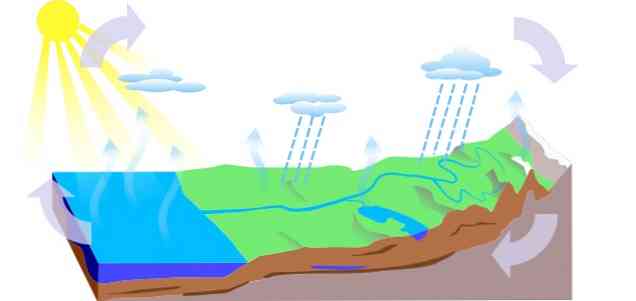
-물주기
지구상의 물 순환은 세 가지 주요 과정으로 구성됩니다 : 증발, 응축 및 강수 3 가지 회로가 파생됩니다.
- 지표 유출수
- 식물의 증발산량
- 물이 지하수 (지하수)로 이동하여 대수층 채널을 통해 순환하고 스프링, 샘 또는 우물을 통해 빠져 나갑니다..
-물주기에 대한 인류 학적 영향
인간 활동은 물주기에 영향을 미친다. 인류 학적 활동의 원인과 결과 중 일부는 다음과 같습니다.
지표 수정
삼림 벌채가있는 산림과 들판의 파괴로 인해 발생합니다. 이것은 증발산 (식물을 통해 물을 섭취하고 증발과 증발을 통해 환경으로 되돌아 감)과 유출량 증가에 의한 물 순환에 영향을 미친다.
지표 유출 증가로 강 유출 및 홍수 증가.
도시화는 또한 다공성 토양이 시멘트와 불 침투성 아스팔트로 대체되어 침투를 불가능하게하므로 토양 표면을 변형시키고 물 순환에 영향을 미친다.
물 순환 오염
물 순환은 전체 생물권을 포함하고 결과적으로 인간에 의해 생성 된 폐기물은 다른 과정에 의해이 순환에 통합된다.
공기 중의 화학 오염 물질은 비에 흡수됩니다. 농약은 토양에 적용되고, 침출수와 대수층 침투를 겪거나, 강, 호수 및 바다로 흘러 들어간다..
또한 지방과 기름의 낭비와 매립지의 침출수는 지하수로의 침투로 끌립니다.
수자원에서 당좌 대월과 함께 물 공급의 추출
당좌 대월과 관련된 이러한 관행은 지하수 및 표층 수의 감소를 초래하고 생태계에 영향을 미치며 국소 적 토양 침강을 일으 킵니다.
환경 토양 화학
토양은 생물권의 균형에서 가장 중요한 요소 중 하나입니다. 그들은 지상의 영양 체인에있는 생산자 인 식물에 정박지, 물 및 영양분을 제공합니다.
바닥
토양은 3 단계의 복잡하고 역동적 인 생태계로 정의 될 수 있습니다 : 광물 및 유기물 지지체의 고체상, 수성 액상 및 기상; 특정 동물 군과 식물 군 (박테리아, 곰팡이, 바이러스, 식물, 곤충, 선충류, 원생 동물).
토양의 성질은 환경 조건과 그 안에서 발생하는 생물학적 활동으로 인해 끊임없이 변화합니다..
지상에 대한 인류 학적 영향
토양 황폐화는 토양의 생산 능력을 감소시켜 생태계에 심오하고 부정적인 변화를 일으킬 수있는 과정입니다.
토양 황폐화를 일으키는 요인은 기후, 생리학, 석회암, 초목 및 인간의 행동입니다..

인간 행동에 의해 발생할 수 있습니다 :
- 토양의 물리적 분해 (예 : 부적절한 재배 및 가축 습관으로 인한 압축).
- 토양의 화학적 분해 (산성화, 알칼리화, 염화, 농약의 오염, 산업 및 도시 활동의 유출 물, 기름 유출 등).
- 생물학적 토양 분해 (유기 물질 함유량의 감소, 식물 덮개의 분해, 질소 고정 미생물의 손실 등).
화학 - 환경 관계
환경 화학은 대기, 수권 및 토양의 세 가지 환경 구획에서 일어나는 다양한 화학 공정을 연구합니다. 환경에서 발생하는 물질의 전 지구적인 이동을 설명하려는 간단한 화학 모델에 대한 추가 초점을 검토하는 것은 흥미로운 일입니다.
-모델 Garrels와 Lerman
Garrels and Lerman (1981)은 대기, 수권, 지구의 지각 및 생물권 구획 사이의 상호 작용을 연구하는 지구 표면의 생지 화학의 단순화 된 모델을 개발했다..
Garrels and Lerman의 모델은 지구의 7 가지 주요 구성 미네랄을 고려합니다 :
- 석고 (CaSO4)
- 황철광 (FeS2)
- 탄산 칼슘 (CaCO3)
- 탄산 마그네슘 (MgCO3)
- 규산 마그네슘 (MgSiO3)
- 산화철 (Fe2O3)
- 실리콘 이산화물 (SiO2)2)
생물권을 구성하는 유기 물질 (살아있는 것과 죽은 것 둘 다)은 CH2또는 생체 조직의 대략적인 화학량 론적 조성.
Garrels and Lerman 모델에서 지질 학적 변화는 행성의 8 개 구성 요소 사이의 물질 이동을 화학 반응과 순 질량 보존 균형을 통해 연구한다.
CO의 축적2 대기 중에
예를 들어, CO의 축적 문제2 이 모델에서 연구 된 분위기는 다음과 같다 : 현재 우리는 생물 지층에 저장된 유기 탄소를 과거의 지질 시대에 지하층에 퇴적 된 석탄, 석유 및 천연 가스로 태우고있다..
화석 연료의 집중적 인 연소의 결과로, CO의 농도2 대기가 증가하고있다..
CO 농도의 증가2 지구 대기에서 그것은 화석 탄소 연소율이 지구의 생지 화학 시스템의 다른 구성 요소 (예를 들어 광합성 생물과 수권)에 의한 탄소 흡수율을 초과하기 때문이다..
이러한 방식으로, CO의 배출2 인간의 활동으로 인한 대기로의 변화는 지구의 변화를 조절하는 규제 시스템을 능가합니다..
생물권의 크기
Garrels와 Lerman에 의해 개발 된 모델은 또한 광합성과 호흡의 균형의 결과로 생물권의 크기가 증가하고 감소한다고 생각한다.
지구상의 생명체 역사에서 생물권의 질량은 광합성 속도가 빨라서 단계적으로 증가했습니다. 그 결과 유기 탄소와 산소 배출량이 순 저장되었다.
콜로라도 주2 + H2O → CH2O + O2
미생물과 고등 동물의 대사 활동으로 호흡하면 유기 탄소가 다시 이산화탄소 (CO2) 및 물 (H2O), 즉, 이전의 화학 반응을 역전시킨다.
물의 존재, 유기 탄소의 저장 및 분자 산소의 생산은 생명체의 존재를위한 근본입니다.
환경 화학 응용
환경 화학은 인간 활동으로 인한 환경 피해의 예방, 완화 및 개선을위한 솔루션을 제공합니다. 이러한 솔루션 중 몇 가지를 언급 할 수 있습니다.
- MOF라고 불리는 신소재 디자인 (영어 약어 : 금속 유기 프레임 워크). 이들은 매우 다공성이며 다음을 수행 할 수 있습니다. CO를 흡수하고 유지합니다.2, H를 얻다.2또는 사막 지역의 공기 기류와 H 저장2 작은 용기에.
- 폐기물을 원자재로 전환하는 것. 예를 들어, 인조 잔디 또는 신발창 생산시 착용 타이어 사용. 또한 바이오 가스 또는 바이오 에탄올의 생성에서 작물 가지 치기 쓰레기의 사용.
- CFC 대체물의 화학 합성.
- 깨끗한 전기의 생성을위한 수소 전지와 같은 대체 에너지의 개발.
- 불활성 필터 및 반응 필터가있는 대기 오염 제어.
- 역 삼투압에 의한 해수 담수화.
- 수중에 현탁 된 콜로이드 물질의 응집을위한 새로운 물질 개발 (정화 공정).
- 호수의 부영양화의 복귀.
- '친환경 화학 (친환경 화학)'의 개발, 유독 한 화학 물질을 덜 유독 한 화합물로 대체하는 추세, '환경 친화적 인'화학 공정. 예를 들어, 독성이 적은 용제 및 원료의 사용, 산업계, 세탁소의 드라이 클리닝 등에 적용됩니다..
참고 문헌
- Calvert, J.G., Lazrus, A., Kok, G.L., Heikes, B.G., Walega, J.G., Lind, J. 및 Cantrell, C.A. (1985). 대류권에서의 산 발생의 화학적 메커니즘. Nature, 317 (6032), 27-35. doi : 10.1038 / 317027a0.
- Crutzen, P.J. (1970). 대기 중 질소 산화물의 영향 Q.J.R. 메테롤. Soc. Wiley-Blackwell. 96 : 320-325.
- Garrels, R.M. Lerman, A. (1981). 퇴적 된 탄소와 황의 Phanerozoic주기. 자연 과학 아카데미의 회보. 미국. 78 : 4,652-4,656.
- Hester, R E. 및 Harrison, R. M. (2002). 지구 환경 변화. 화학 왕립 학회. pp 205.
- 하이트, 알. 에이. (2007). 환경 화학의 요소. Wiley-Interscience. pp 215.
- Manahan, S. E. (2000). 환경 화학. 일곱 번째 판. CRC pp 876
- Molina, M.J. and Rowland, F.S. (1974). 클로로 플루오로 메탄의 성층권 흡수 : 염소 원자에 의한 오존 파괴. 자연 249 : 810-812.
- Morel, F.M. and Hering, J.M. (2000). 수생 화학의 원리와 응용. 뉴욕 : John Wiley.
- Stockwell, W.R., Lawson, C.V., Saunders, E. 및 Goliff, W.S. (2011). 대기 질 모델링을위한 대류권 대기 화학 및 가스상 화학 메커니즘의 고찰. 대기, 3 (1), 1-32. doi : 10.3390 / atmos3010001


