발견 된 자연의 탄소와 방법, 특성, 용도
그 자연의 탄소 그것은 다이아몬드, 기름 및 낙서에서, 다른 많은 대본 중에서, 찾아 낼 수있다. 이 화학 원소는 주기율표에서 여섯 번째 자리를 차지하고 수평 행 또는 기간 2와 열 14에 위치합니다. 이는 비금속 및 4가입니다. 즉 공유 전자 또는 공유 결합의 4 화학 결합을 확립 할 수 있습니다..
탄소는 지구의 지각에서 가장 풍부한 원소입니다. 이러한 풍부함, 유기 화합물의 형성에서의 독특한 다양성, 지구상에서 흔히 볼 수있는 온도에서 거대 분자 또는 고분자를 형성하는 예외적 인 능력은 모든 알려진 생명체의 공통 요소로 작용합니다.

탄소는 자연계에서 흑연과 다이아몬드의 형태로 결합하지 않고 화학 원소로 존재합니다. 그러나 대부분의 경우 탄산 칼슘 (CaCO)과 같은 화학 탄소 화합물을 형성하기 위해 결합됩니다.3) 및 석유 및 천연 가스의 기타 화합물.
또한 무연탄, 석탄, 갈탄 및 이탄과 같은 여러 광물을 형성합니다. 탄소의 가장 큰 중요성은 소위 "생명의 빌딩 블록 (building block of life)"을 구성하고 모든 생물체에 존재한다는 것입니다.
색인
- 1 탄소는 어디에서 발견되며 어떤 형태로 존재 하는가??
- 1.1 크리스탈 모양
- 1.2 무정형
- 1.3 석유, 천연 가스 및 암갈색
- 2 물리 화학적 특성
- 2.1 화학 기호
- 2.2 원자 번호
- 2.3 물리적 상태
- 2.4 색상
- 2.5 원자 질량
- 2.6 융점
- 2.7 끓는점
- 2.8 밀도
- 2.9 용해도
- 2.10 전자 구성
- 2.11 외부 또는 원자가 층의 전자 수
- 2.12 링크 용량
- 2.13 카 테나 시온
- 3 Biogeochemical주기
- 3.1 광합성
- 3.2 호흡과 분해
- 3.3 지질 학적 과정
- 3.4 인간 활동의 간섭
- 4 용도
- 4.1 석유 및 천연 가스
- 4.2 흑연
- 4.3 다이아몬드
- 4.4 무연탄
- 4.5 단단한 석탄
- 4.6 갈탄
- 4.7 이탄
- 5 참고
탄소는 어디에서 발견되며 어떤 형태로 존재 하는가??
모든 형태의 생명체에 공통적 인 화학 성분 인 것 외에도 자연적으로 존재하는 탄소는 다이아몬드, 흑연 및 풀러린의 세 가지 형태로 존재합니다.
석탄 (무연탄, 갈탄, 석탄, 이탄), 액체 형태 (오일의 종류) 및 탄산 음료 (천연 가스).
크리스탈 모양
결정 형태에서, 탄소 원자는 기하학적 공간 배열을 갖는 규칙적인 패턴을 형성하도록 결합한다.
흑연
광택이 있거나 광택이 있고 열에 강한 내화물입니다. 그 결정 구조는 육각형 고리에 결합 된 탄소 원자를 나타내며, 차례로 결합 시트를 형성한다.
흑연 예금은 드물고 중국, 인도, 브라질, 북한 및 캐나다에서 발견되었습니다..
다이아몬드
그것은 매우 단단하고 빛의 통과에 투명하며 흑연보다 훨씬 밀도가 높습니다. 다이아몬드 밀도의 값은 흑연의 밀도의 거의 두 배에 해당합니다.
다이아몬드의 탄소 원자는 사면체 기하학에 참여합니다. 마찬가지로, 다이아몬드는 매우 높은 온도와 압력 (3000 °C 및 100 000 기압).
대부분의 다이아몬드는 맨틀에서 140 ~ 190km 깊이에 위치하고 있습니다. 깊은 화산 분출을 통해, 마그마는 그들을 지표 근처의 거리까지 수송 할 수 있습니다..
아프리카 (나미비아, 가나, 콩고 민주 공화국, 시에라 리온, 남아프리카), 아메리카 (브라질, 콜롬비아, 베네수엘라, 가이아나, 페루), 오세아니아 (호주), 아시아 (인도).

Fulerenos
그들은 축구 공과 비슷하게 거의 구형 분자 내에 60 및 70 개의 탄소 원자의 클러스터를 형성하는 분자 형태의 탄소입니다..
탄소 원자 20 개보다 작은 풀러렌도있다. 풀러렌의 일부 형태는 탄소 나노 튜브 및 탄소 섬유를 포함한다.

무정형
비정질 형태에서 탄소 원자는 단결하지 않고 질서 정연하고 규칙적인 결정 구조를 구성한다. 대신 다른 원소의 불순물도 포함하고 있습니다..
무연탄
1 차 또는 고생대의 석탄 형성 이후 석탄기 시대 (석탄기의 온도, 압력 또는 액체의 화학적 작용에 의한 암석의 변형으로부터 유래)는 가장 오래된 변성 미네랄 석탄이다..
무연탄은이 원소의 함량이 더 높은 무정형의 탄소 (86 ~ 95 %)입니다. 그레이 블랙과 메탈릭 광택이며 무겁고 콤팩트합니다..
일반적으로 무연탄은 지질 학적 변형 영역에서 발견되며 세계 석탄 매장량의 약 1 %를 차지합니다.
지리적으로 캐나다, 미국, 남아프리카 공화국, 프랑스, 영국, 독일, 러시아, 중국, 호주 및 콜롬비아에서 발견됩니다..

단단한 석탄
그것은 미네랄 석탄으로, 유기 기원의 퇴적암으로, 그 형성은 고생대와 중생대에서 시작됩니다. 탄소 함량은 75 ~ 85 %.
그것은 흑색이며, 역청 질 물질의 함량이 높기 때문에 불투명하고 끈적 끈적한 외관을 특징으로합니다. 그것은 석 생과 페름기 기간에있는 고생대의 갈탄 압축에 의해 형성된다..
그것은 지구상에서 가장 풍부한 형태의 석탄입니다. 미국, 영국, 독일, 러시아 및 중국에 대규모 석탄 매장량이 있습니다..
갈탄
그것은 압축 (고압)에 의해 토탄에서 3 차 시대에 형성된 화석 미네랄 석탄입니다. 석탄보다 탄소 함량이 70 ~ 80 %.
그것은 약간 콤팩트 한 재료로, 부서지기 쉽고 (다른 탄소 미네랄과 구별되는 특성) 갈색 또는 검은 색입니다. 그 질감은 목재와 비슷하며 탄소 함량은 60 ~ 75 %.
이탄보다 발열량이 적고 수분 함량이 적은 착화 연료입니다..
독일, 러시아, 체코, 이탈리아 (베네토 지역, 투스카니, 움 브리아) 및 사르데냐에는 중요한 갈탄 광산이 있습니다. 스페인에서는 갈탄 매장량이 아스투리아스, 안도라, 사라고사, 라 코 루나에 있습니다..
이탄
그것은 이전의 석탄보다 훨씬 최근의, 제 4 기 시대로부터 온 유기 기원의 물질이다.
그것은 갈색 황색이며 저밀도 해면질 덩어리로 나타납니다.이 덩어리는 식물이 원래 있던 곳의 유적을 볼 수 있습니다.
위에서 인용 한 석탄과는 달리, 이탄은 목질 재료 또는 목재의 탄화 과정에서 비롯된 것이 아니며, 완료되지 않은 탄화 과정을 통해 습지 지역의 식물 (주로 허브 및 이끼류)이 축적 됨으로써 형성되었습니다..
이탄은 수분 함량이 높다. 이러한 이유로 그것은 사용하기 전에 건조 및 압축을 필요로합니다..
그것은 낮은 탄소 함량 (55 % 만); 따라서 에너지 값이 낮습니다. 연소 될 때, 그 잔사 (ash residue)는 풍부하고 많은 연기를 낸다..
칠레, 아르헨티나 (Tierra del Fuego), 스페인 (Espinosa de Cerrato, Palencia), 독일, 덴마크, 네덜란드, 러시아, 프랑스에서는 중요한 이탄 매장지가 있습니다.

석유, 천연 가스 및 역청
오일 (라틴계) 페트레, "돌"을 의미합니다. 및 발연, "오일"을 의미하는 "오일": "암석 오일")은 많은 유기 화합물 (대부분의 탄화수소)의 혼합물로 유기물의 혐기성 박테리아 분해 (산소가없는 경우)에 의해 생성됩니다..
그것은 수십억 년이 걸린 과정에서 물리적 깊이 (고압 및 온도)와 화학적 (특정 촉매 화합물의 존재)의 심층 및 특수 조건 하에서 하층토에서 형성되었습니다.
이 과정에서 C와 H는 유기 조직에서 방출되어 다시 재결합하여 그 특성에 따라 혼합 된 거대한 수의 탄화수소를 형성하여 천연 가스, 오일 및 역청을 형성합니다.
행성의 유전은 주로 베네수엘라, 사우디 아라비아, 이라크,이란, 쿠웨이트, 아랍 에미리트, 러시아, 리비아, 나이지리아 및 캐나다에 있습니다..
러시아,이란, 베네수엘라, 카타르, 미국, 사우디 아라비아 및 아랍 에미리트 연합에 천연 가스 매장량이있다..
물리 화학적 특성
탄소 속성 중 다음을 언급 할 수 있습니다 :
화학 기호
C.
원자 번호
6.
물리적 상태
보통 압력 및 온도 조건에서 고체 (1 기압 및 25 기압) °C).
색상
회색 (흑연) 및 투명 (다이아몬드).
원자 질량
12,011 g / mol.
융점
500 °C.
끓는점
827 °C.
밀도
2.62 g / cm3.
용해도
물에 불용성이며 사염화탄소 CCl에 용해 됨4.
전자 구성
1 초2 2 초2 2p2.
외부 층 또는 전자 원자의 전자 수
4.
링크 용량
4.
카 네이션
그것은 긴 사슬에서 화합물을 형성하는 능력이 있습니다.
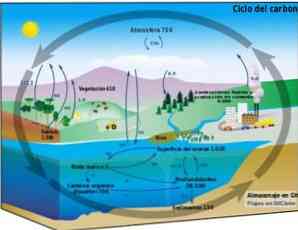
생지 화학 사이클
탄소 순환은 탄소가 생물권, 대기, 수권 및 육지의 암석권 사이에서 교환 될 수있는 원형 생지 화학적 과정이다.
지구상의 순환 탄소 과정에 대한 지식은이주기에 대한 인간의 행동과 지구 기후 변화에 대한 그 결과를 입증 할 수있게한다.
탄소는 해양과 다른 수역 사이뿐만 아니라 암석권, 토양 및 토양, 대기 및 생물권 사이에서도 순환 할 수 있습니다. 대기와 수권에서, 탄소는 기체 형태로 CO2 (이산화탄소).
광합성
대기 중의 탄소는 생태계의 육상 생물 및 수생 생물 (광합성 생물)에 의해 포획된다..
광합성은 CO와 화학 반응을 일으킨다.2 태양 에너지와 엽록소 식물에 의해 매개 물은 탄수화물이나 설탕을 생산합니다. 이 과정은 낮은 CO 에너지 함량을 갖는 단순한 분자를 변환시킨다.2, H2O 및 산소 O2, 당분 인 고 에너지의 복잡한 분자 형태로.
광합성을 수행 할 수없고 생태계의 소비자 인 종속 영양 생물은 생산자와 다른 소비자의 먹이를 먹을 때 탄소와 에너지를 얻습니다.
호흡 및 분해
호흡과 분해는 CO의 형태로 탄소를 환경으로 방출시키는 생물학적 과정이다.2 또는 CH4 (혐기성 분해에서 생성 된 메탄, 즉 산소가없는 메탄).
지질 학적 과정
지질 학적 과정을 통해 그리고 시간의 경과에 따라 혐기성 분해의 탄소는 석유, 천연 가스 및 석탄과 같은 화석 연료로 변형 될 수 있습니다. 마찬가지로 탄소도 다른 미네랄과 암석의 일부입니다.
인간 활동의 간섭
사람이 화석 연료를 연소시켜 에너지로 사용할 때, 탄소는 거대한 양의 CO 형태로 대기로 되돌아 간다.2 탄소의 자연 생지 화학 순환에 의해 동화 될 수없는.
이 과량의 일산화탄소2 인간 활동에 의해 생성 된 탄소 순환은 탄소 순환의 균형에 부정적인 영향을 주며 지구 온난화의 주요 원인이다.
용도
탄소와 그 화합물의 용도는 매우 다양합니다. 가장 뛰어난 것 :
석유 및 천연 가스
탄소의 주요 경제적 용도는 화석 연료 탄화수소 (예 : 메탄 가스 및 석유)로 사용됩니다..
오일은 이러한 차례로 플라스틱, 비료, 의약품 및 도료의 원료를 생산하는 석유 화학 공업에 사용되는 가솔린, 경유, 등유, 아스팔트, 윤활제, 용제 등, 여러 유도체를 얻기 정유 증류 , 다른 사람들과.
흑연
흑연은 다음 작업에서 사용됩니다.
- 점토와 혼합 된 연필 제조에 사용됩니다..
- 그것은 내화 벽돌 및 도가니의 제조의 일부이며 내열성이다..
- 와셔, 베어링, 피스톤 및 개스킷과 같은 다양한 기계 장치.
- 우수한 고체 윤활제입니다..
- 전기 전도성 및 화학적 불활성 때문에 전극, 전기 모터 석탄의 제조에 사용됩니다.
- 원자력 발전소의 사회자로 사용됩니다..
다이아몬드
다이아몬드는 지금까지 알려진 높은 경도 및 열전도도와 같은 예외적 인 물리적 특성을 가지고 있습니다.
이러한 특징들은 높은 마모성을 위해 절삭 및 연마 장비를 만드는 데 사용되는 공구에 산업 응용을 허용합니다.
투명성과 백색광을 분해하고 빛을 굴절시키는 능력과 같은 광학 특성은 렌즈 및 프리즘 제조와 같은 광학 기기에서 많은 응용 분야를 제공합니다.
자사의 광학 특성에서 파생 된 특성 밝기는 또한 보석 업계에서 매우 높이 평가됩니다.
무연탄
무연탄은 점화가 어렵고, 연소 속도가 느리고 산소가 많이 필요합니다. 그것의 연소는 옅은 푸른 색의 화염을 거의 발생시키지 않고 많은 열을 방출한다..
몇 년 전, 무연탄은 열전 발전소 및 가정 난방에 사용되었습니다. 그것의 사용에는 작은 재 또는 먼지, 적은 연기 및 느린 연소 과정의 생산과 같은 이점이있다.
높은 경제적 비용과 희소성으로 인해, 무연탄은 열전 발전소의 천연 가스와 가정의 전력으로 대체되었습니다.
단단한 석탄
석탄은 다음을 얻기 위해 원료로 사용됩니다.
- 코크스, 철강 공장 용광로에서 연료.
- 경질 석탄에서 타르 증류 액을 혼합하여 얻은 크리오소트 (Creosote) 및 날씨에 노출 된 목재 용 보호 밀봉 제로 사용.
- 석탄에서 추출하여 소독제 및 방부제로 사용되는 크레졸 (화학적으로 메틸 페놀),
- 가스, 타르 또는 피치와 같은 기타 유도체, 향수, 살충제, 플라스틱, 도료, 타이어 및 도로 포장의 제조에 사용되는 화합물.
갈탄
갈탄은 중간 품질의 연료를 나타냅니다. 제트, 갈탄의 다양성은 탄화와 고압의 긴 과정에 의해 매우 콤팩트 한 것이 특징이며 보석과 장식에 사용됩니다.
이탄
이탄은 다음과 같은 활동에서 사용됩니다;
- 식물 종의 성장, 지원 및 운송.
- 유기질 비료로서.
- 마구간에있는 동물의 침대처럼.
- 저품질 연료로서.
참고 문헌
- Burrows, A., Holman, J., Parsons, A., Pilling, G. and Price, G. (2017). Chemistry3 : 무기, 유기 및 물리 화학 소개. 옥스포드 대학 출판부.
- Deming, A. (2010). 요소의 왕? 나노 기술 21 (30) : 300201 doi : 10.1088
- Dienwiebel, M., Verhoeven, G., Pradeep, N., Frenken, J., Heimberg, J. 및 Zandbergen, H. (2004). 흑연의 초 연성. 물리적 검토 편지. 92 (12) : 126101, doi : 10.1103
- Irifune, T., Kurio, A., Sakamoto, S., Inoue, T. 및 Sumiya, H. (2003). 재료 : 흑연으로 만든 초경 다 결정질 다이아몬드. 자연 421 (6923) : 599-600. doi : 10.1038
- Savvatimskiy, A. (2005). 흑연의 융점 및 액체 탄소의 특성 측정 (1963-2003 년 검토). 탄소. 43 (6) : 1115. doi : 10.1016


