Sarcomere 구조 및 부품, 기능 및 조직학
A 육식 동물 그것은 줄무늬 근육의 기본 기능 단위, 즉, 골격과 심장 근육입니다. 골격 근육은 자발적인 운동에 사용되는 근육의 유형이며 심장 근육은 심장의 일부분 인 근육입니다.
sarcomere가 기능 단위라고 말하는 것은 수축에 필요한 모든 구성 요소가 각 sarcomere에 포함되어 있음을 의미합니다. 실제로 끈이있는 근육은 수백만 개의 작은 sarcomeres로 구성되어 있으며 각 근육의 수축과 함께 개별적으로 짧아집니다.
여기에 sarcomere의 주요 목적이있다. sarcomeres는 일제히 계약함으로써 큰 움직임을 시작할 수 있습니다. 독특한 구조로 인해이 작은 단위는 근육의 수축을 조정할 수 있습니다..
사실, 근육의 수축 특성은 동물의 움직임을 현저하게 부드럽고 복잡하게하기 때문에 동물의 특성을 정의합니다. 운동은 근육의 길이가 변화 할 때 근육의 길이를 변화시켜야하는데 근육 단축을 가능하게하는 분자 구조가 필요합니다..
색인
- 1 구조 및 부품
- 1.1 근원 섬유
- 1.2 Myosin과 액틴
- 1.3 Myofilaments
- 2 함수
- 2.1 myosin의 참여
- 2.2 myosin과 actiba의 연합
- 3 조직학
- 3.1 밴드 A
- 3.2 구역 H
- 3.3 밴드 I
- 3.4 Z 디스크
- 3.5 라인 M
- 4 참고
구조 및 부품
골격 근육 조직을 면밀히 검사하면 줄무늬라고하는 줄무늬 모양이 관찰됩니다. 이 "줄무늬"는 다른 단백질 필라멘트에 해당하는 번갈아 가며 번갈아 가며 밝고 어두운 패턴을 나타냅니다. 즉,이 줄무늬는 각 근육질을 구성하는 인터 레이스 된 단백질 섬유에 의해 형성됩니다.
근원 섬유
근육 섬유는 myofibrils라고 불리는 수백에서 수천 개의 수축성 세포 소기관으로 이루어져 있습니다. 이러한 근원 섬유는 근육 조직을 형성하기 위해 평행하게 배열됩니다. 그러나 근원 섬유 자체는 본질적으로 고분자, 즉 반복적 인 단위 조직.
근원 섬유 (myofibrils)는 섬유질과 긴 구조로 구성되어 있으며 두 종류의 단백질 필라멘트로 이루어져 있습니다..
미오신과 액틴
미오신은 구형 머리가있는 두꺼운 섬유이며 액틴은 근육 수축 과정에서 미오신과 상호 작용하는 얇은 필라멘트입니다.
주어진 myofibril은 대략 10,000 개의 sarcomeres를 포함하며, 각각의 길이는 약 3 마이크로 미터입니다. 각각의 근절은 작지만, 몇 가지 골재 사르코어는 근섬유의 길이에 걸쳐 있습니다.
Myofilaments
각각의 근육은 위에서 언급 한 단백질의 두껍고 얇은 광선으로 이루어지며,이 두 근육을 함께 myofilaments.
myofilaments의 일부를 확장함으로써, 당신은 그들을 만드는 분자를 확인할 수 있습니다. 두꺼운 필라멘트는 미오신 (myosin)으로되어 있고,가는 필라멘트는 액틴 (actin)으로 만들어져 있습니다..
액틴 (actin)과 미오신 (myosin)은 서로 상호 작용할 때 근육이 짧아지는 수축 단백질입니다. 또한, 얇은 필라멘트는 수축 단백질들 사이의 상호 작용을 조절하는 트로포 닌 (troponin) 및 트로포 미오신 (tropomyosin).
기능들
sarcomere의 주요 기능은 근육 세포가 수축하도록 허용하는 것입니다. 이를 위해 신경 자극에 반응하여 근육 강화제를 단축해야합니다..
두껍고 얇은 필라멘트는 짧게하지 않고 서로 밀어 주며 필라멘트가 같은 길이를 유지하면서 줄여서 줄을 만듭니다. 이 과정은 근육 수축의 슬라이딩 필라멘트 모델로 알려져 있습니다..
필라멘트의 미끄러짐은 근육 긴장을 발생 시키며, 이는 의심 할 여지없이 근육질의 주요 기여입니다. 이 동작은 근육에게 신체적 힘을줍니다..
이것에 대한 간단한 비유는 물리적으로 금속 부분을 단축시키지 않고도 우리의 필요에 따라 긴 사다리를 확장하거나 접을 수있는 방법입니다.
미오스 참여
다행히도 최근의 연구는 이러한 미끄러짐이 어떻게 작용 하는지를 잘 보여줍니다. 슬라이딩 필라멘트의 이론은 미오신이 액틴을 끌어 당겨서 근육의 길이를 줄이는 방법을 포함하도록 수정되었습니다.
이 이론에서, myosin의 구상 머리는 S1 영역이라 불리는 영역에서 액틴 근처에 위치해 있습니다. 이 영역은 구부러 질 수있는 경첩이있는 세그먼트가 풍부하여 수축을 촉진합니다..
S1의 굴곡은 미오신이 액틴 필라멘트를 따라 "걸어 갈"수있는 방법을 이해하는 열쇠 일 수 있습니다. 이것은 S1 미오신 단편의 결합주기, 그것의 수축 및 최종 방출에 의해 달성된다.
myosin과 actiba의 연합
myosin과 actin이 함께 올 때, 그들은 "crossed bridge"라고 불리는 확장 물을 형성합니다. 이러한 교차 교량은 수축을 가능하게하는 에너지 분자 인 ATP의 존재 (또는 부재)로 형성되고 파괴 될 수있다.
ATP가 액틴 필라멘트에 결합하면, ATP는 미오신 결합 부위를 노출시키는 위치로 이동한다. 이것은 myosin의 구형 머리가이 부위에 부착되어 교차 다리를 형성하게합니다.
이 결합은 ATP의 인산염 그룹을 해리시키고, 따라서 미오신은 그 기능을 개시한다. 다음, myosin는 sarcomere가 단축 될 수있는 낮은 에너지의 국가에 진입합니다.
교차 다리를 끊고 다음주기에 액틴에 미오신의 결합을 다시 허용하려면 ATP의 또 다른 분자를 미오신에 결합시키는 것이 필요합니다. 즉, ATP 분자는 수축 및 이완 모두에 필요하다..
조직학
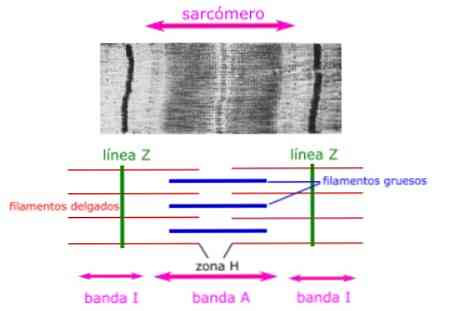
근육의 조직 학적 섹션은 sarcomeres의 해부학 적 특성을 보여줍니다. myosin으로 구성된 두꺼운 필라멘트가 보이고 sarcomere의 A 밴드로 표현됩니다..
얇은 필라멘트는 액틴으로 구성되어 알파 - 액틴 (alpha-actinin)이라 불리는 Z 디스크 (또는 Z 라인)의 단백질에 결합하며 밴드 I의 전체 길이와 밴드 A의 일부분을 따라 존재합니다.
두꺼운 필라멘트와 얇은 필라멘트가 겹치는 영역은 필라멘트 사이에 공간이 거의 없으므로 밀도가 높습니다. 얇고 두꺼운 필라멘트가 겹치는이 영역은 필라멘트의 움직임이 시작되는 곳이기 때문에 근육 수축에 매우 중요합니다..
얇은 필라멘트는 두꺼운 필라멘트 만 포함하는 밴드 A의 중앙 영역을 떠나 밴드 A에서 완전히 확장되지 않습니다. 이 밴드 A의 중앙 영역은 밴드 A의 나머지 부분보다 약간 가벼워 보이며, 영역 H.
영역 H의 중심에는 M 라인이라는 수직선이 있는데, 액세서리 단백질은 두꺼운 필라멘트.
sarcomere의 조직학의 주요 구성 요소는 다음과 같습니다 :
밴드 A
미오신 단백질로 구성된 두꺼운 필라멘트 구역.
영역 H
근육이 이완 될 때 겹쳐지는 액틴 단백질이없는 밴드 A의 중심 구역.
밴드 나
액틴 단백질로 구성된 얇은 필라멘트 영역 (미오신없이).
Z 디스크
인접한 sarcomeres 사이의 경계는 액틴 결합 단백질에 의해 형성되어 육체에 수직인가?.
라인 M
액세서리 단백질에 의해 형성된 중앙 영역. 그들은 마이 오신 (myosin)의 두꺼운 필라멘트의 중앙에 위치하며,.
전술 한 바와 같이, 수축은 두꺼운 필라멘트가 미세 필라멘트를 따라 빠르게 연속적으로 활주하여 근원 섬유를 짧게 할 때 발생한다. 그러나 기억해야 할 중요한 특징은 근섬유 자체가 수축되지 않는다는 것입니다. 그 (것)들에게 짧거나 길게하는 힘을주는 미끄러지는 활동이다.
참고 문헌
- Clarke, M. (2004). 50시 슬라이딩 필라멘트. 자연, 429(6988), 145.
- Hale, T. (2004) 운동 생리학 : 주제별 접근법 (1 판). 와일리
- Rhoades, R. & Bell, D. (2013). 의학 생리학 : 임상 의학을위한 원리 (4 판). Lippincott Williams & Wilkins.
- Spudich, J. A. (2001). 미오신 스윙 크로스 - 브릿지 모델. 자연 리뷰 분자 세포 생물학, 2(5), 387-392.
- Thibodeau, P. (2013). 해부학 및 생리학 (8일). Mosby, Inc.
- Tortora, G. & Derrickson, B. (2012). 해부학 및 생리학의 원리 (13th ed.). 존 와일리 선즈를 Inc.


